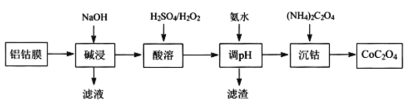
题目内容
【题目】设![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,![]() 分子中含有
分子中含有![]()
![]() 个碳氧双键
个碳氧双键
B.一定温度下,![]() 完全反应转移的电子数一定为
完全反应转移的电子数一定为![]()
![]()
C.常温常压下,![]() 固体中离子总数为
固体中离子总数为![]()
![]()
D.常温常压下,![]() 溶液中
溶液中![]() 和
和![]() 数目之和为
数目之和为![]()
【答案】C
【解析】
A.标况下,![]() 二氧化碳的物质的量n=
二氧化碳的物质的量n=![]() =
=![]() =
=![]() ,根据二氧化碳的结构,而一个二氧化碳分子中含2个碳氧双键,故
,根据二氧化碳的结构,而一个二氧化碳分子中含2个碳氧双键,故![]() 二氧化碳中含1mol碳氧双键即
二氧化碳中含1mol碳氧双键即![]() 个,故A错误;
个,故A错误;
B.氯气反应后的价态可能为![]() 、
、![]() 、+5、
、+5、![]() 价,还可能发生歧化反应,例如2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,1mol氯气反应后转移的电子的物质的量为1mol,数目为NA,0.1mol氯气反应后转移的电子的数目为0.1NA,故
价,还可能发生歧化反应,例如2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,1mol氯气反应后转移的电子的物质的量为1mol,数目为NA,0.1mol氯气反应后转移的电子的数目为0.1NA,故![]() 氯气反应后转移的电子不一定为
氯气反应后转移的电子不一定为![]() 个,故B错误;
个,故B错误;
C.氯化镁的摩尔质量为95g/mol,![]() 氯化镁的物质的量n=
氯化镁的物质的量n=![]() =
=![]() ,根据镁的化学式,而1mol氯化镁中含1mol镁离子和2mol氯离子,故
,根据镁的化学式,而1mol氯化镁中含1mol镁离子和2mol氯离子,故![]() 氯化镁中含
氯化镁中含![]() 离子,N=nNA=
离子,N=nNA=![]() 个,故C正确;
个,故C正确;
D.碳酸钠的物质的量![]() ,由于
,由于![]() 能水解为
能水解为![]() 和
和![]() ,根据物料守恒可知,
,根据物料守恒可知,![]() 、
、![]() 和
和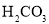 的数目之和为
的数目之和为![]() 个,故D错误。
个,故D错误。
答案选C。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 2×10-5 |
HClO | HClO | 3.0×10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.61×10-11 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是__(填化学式)。
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为__。
(3)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是_。
A.c(H+) B.c(H+)c(CH3COO-) C.c(H+)c(OH-) D.![]()
(4)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1__V2(填“>”、“<”或“=”)。
(5)下列四种离子结合H+能力最强的是__。
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(6)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是___
A.Va>10Vb B.Va<10Vb C.Vb<10Va D.Vb>10Va
(7)25℃时,0.1mol/L CH3COOH溶液的pH约为3,向其中加入CH3COONa晶体,待晶体溶解后发现溶液的pH增大。可能的原因有:①__;②__;为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L CH3COOH溶液中加入少量下列物质中的__(选填字母编号),然后测定溶液的pH。
a.CH3COOK固体 b.CH3COONH4固体 c.NH3 d.NaHCO3固体
(8)已知100℃时,水的离子积常数Kw=1.0×10-12,pH=3的CH3COOH和pH=9的NaOH溶液等体积混合,混合溶液呈__性;
(9)等浓度的①(NH4)2SO4、②NH4HSO4、③NH4HCO3、④NH4Cl、⑤NH3H2O溶液中,NH4+浓度由大到小的顺序是:___。