题目内容
【题目】(1)14.2gC12含_________个氯气分子,_______摩尔氯原子,标准状况下所占的体积为________升,与这些Cl2分子数相同H2的质量是__________g,它们恰好完全反应后得到的氯化氢气体的物质的量是________摩尔,质量为________g,在标准状况下是_______升,将产生的氯化氢气体溶于490.4 mL水中,则所得溶液的质量为________g,若所得溶液的密度为1.01g/cm3,则该溶液的体积为_________ L。溶液的物质的量浓度为_________mol/L,质量分数为__________。
(2)在下列物质:① 烧碱②SO3 ③ 铁片④ 石墨⑤ 甲烷 ⑥醋酸 ⑦盐酸 ⑧硫酸钡,属于电解质的是__________(请填序号,下同),其中属于强电解质的是____________,属于非电解质的是__________,既不属于电解质又不属于非电解质的是____________。
(3)标准状况下,1 体积水能溶解448 体积HCl,所得溶液的密度为1.2g/mL,该溶液的质量分数和物质的量的浓度分别是____________、_____________。(保留1位小数)
【答案】
(1)0.2NA;0.4;4.48;0.4;0.4;14.6;8.96;505.0;0.5;0.8;2.9%
(2)①⑥⑧;①⑧;②⑤;③④⑦。
(3)42.2%;13.9mol/L;
【解析】
试题分析:(1) 14.2gCl2的物质的量n=![]() =
=![]() =0.2mol;含氯气分子N = nNA = 0.2mol × 6.02 × 1023mol-1=1.204×1023个;含氯原子的物质的量n(Cl)=2n(Cl2)=2×0.2mol=0.4mol;标准状况下所占体积=n(Cl2)Vm=0.2mol×22.4L/mol=4.48L;若使氢气的分子数相同,则氢气的物质的量n(H2)=n(Cl2)=0.2mol;氢气的质量=0.2mol×2g/mol=0.4g;设生成氯化氢的物质的量为X
=0.2mol;含氯气分子N = nNA = 0.2mol × 6.02 × 1023mol-1=1.204×1023个;含氯原子的物质的量n(Cl)=2n(Cl2)=2×0.2mol=0.4mol;标准状况下所占体积=n(Cl2)Vm=0.2mol×22.4L/mol=4.48L;若使氢气的分子数相同,则氢气的物质的量n(H2)=n(Cl2)=0.2mol;氢气的质量=0.2mol×2g/mol=0.4g;设生成氯化氢的物质的量为X
H2+Cl2![]() 2HCl
2HCl
1 2
0.2mol X
X=0.4mol;生成氯化氢的质量=nM=0.4mol×36.5g/mol=14.6g;标准状况下氯化氢的体积=nVm=0.4mol×22.4L/mol=8.96L;所得溶液的质量=14.6g+490.4ml×1g/ml=505g;该溶液体积=![]() =500ml;溶液的物质的量=
=500ml;溶液的物质的量=![]() =0.8molL-1;质量分数=
=0.8molL-1;质量分数=![]() ×100%=2.9%,故答案为:1.204×1023;0.4;4.48L;0.4;0.4;14.6;8.96;505;0.5;0.8;2.9%.
×100%=2.9%,故答案为:1.204×1023;0.4;4.48L;0.4;0.4;14.6;8.96;505;0.5;0.8;2.9%.
(2)电解质为在溶液中或熔融状态下能够导电的化合物,满足该条件的有:烧碱、醋酸、硫酸钡;强电解质在溶液中能够完全电离,满足条件下的为:烧碱、硫酸钡;属于非电解质的是SO3、甲烷,既不属于电解质又不属于非电解质的为单质或混合物,满足条件的有:铁片、石墨、盐酸,故答案为:①⑥⑧;①⑧;②⑤;③④⑦。
(3)设水的体积为1L,则HCl的体积为448L,标况下HCl物质的量=![]() =20mol,HCl质量为20mol×36.5g/mol=730g,溶液质量=1L×1000g/L+730g=1730g,溶液质量分数=
=20mol,HCl质量为20mol×36.5g/mol=730g,溶液质量=1L×1000g/L+730g=1730g,溶液质量分数=![]() ×100%=42.2%,溶液体积=
×100%=42.2%,溶液体积=![]() =
=![]() L,则物质的量浓度为
L,则物质的量浓度为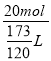 =13.9molL-1,故答案为:42.2%;13.9molL-1。
=13.9molL-1,故答案为:42.2%;13.9molL-1。

【题目】元素A的各级电离能数据如下:
I1 | I2 | I3 | I4 | I5 | I6 | |
I/(kJ·mol-1) | 578 | 1 817 | 2 745 | 11 578 | 14 831 | 18 378 |
则元素A常见价态是( )
A. +1 B. +2 C. +3 D. +4