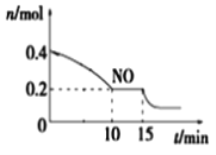
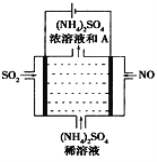
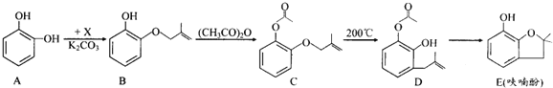
题目内容
【题目】25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液。
(1)则0.1 mol·L-1一元弱酸HA的电离平衡常数表达式Ka=______________。
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为____________。
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为_________;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是__________。
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
(5)实验室在配制溶液时,一些物质存在水解的情况,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式__________,为了防止Al2(SO4)3发生水解,可加入少量的__________.
(6)已知25 ℃,碳酸的电离平衡常数Ka1= 4.0×10-7,Ka2= 5.6×10-11,则该温度下NaHCO3的水解平衡常数Kh=_____________。
【答案】 C(A-).C(H+ )/C( HA) 5.0×10-14 19:11 ②③⑤⑥ Al3++3H2O![]() Al(OH)3+3H+ 硫酸 2.5×10-8
Al(OH)3+3H+ 硫酸 2.5×10-8
【解析】
(1)根据一元弱酸HA的电离方程:HA![]() H++A-写出电离平衡常数表达式;(2)水电离的氢离子等于溶液中氢氧根离子浓度;(3)由反应后溶液的pH为2,列出计算式;(4)加水稀释弱酸,促进弱酸电离,但氢离子浓度减小,温度不变水的离子积常数不变,则溶液中氢氧根离子浓度增大,据此分析解答。(5)由水解平衡原理解答;(6)根据Kh=c(H2CO3)c(OH-)/c(HCO3-)求解。
H++A-写出电离平衡常数表达式;(2)水电离的氢离子等于溶液中氢氧根离子浓度;(3)由反应后溶液的pH为2,列出计算式;(4)加水稀释弱酸,促进弱酸电离,但氢离子浓度减小,温度不变水的离子积常数不变,则溶液中氢氧根离子浓度增大,据此分析解答。(5)由水解平衡原理解答;(6)根据Kh=c(H2CO3)c(OH-)/c(HCO3-)求解。
(1)一元弱酸HA的电离方程:HA![]() H++A-,0.1 mol·L-1一元弱酸HA的电离平衡常数表达式Ka= C(A-).C(H+ )/C( HA)。(2)0.1mol·L-1的H2SO4中水电离出的C(H+)=
H++A-,0.1 mol·L-1一元弱酸HA的电离平衡常数表达式Ka= C(A-).C(H+ )/C( HA)。(2)0.1mol·L-1的H2SO4中水电离出的C(H+)=![]() mol·L-1=5.O×10-14mol·L-1。(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,设所需NaOH溶液体积为x与硫酸的体积为y,
mol·L-1=5.O×10-14mol·L-1。(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,设所需NaOH溶液体积为x与硫酸的体积为y,![]() ,x:y=19:11;(4)①加水稀释促进弱酸电离,氢离子的物质的量增大,但溶液体积增大的倍数大于氢离子增大的物质的量,溶液氢离子浓度减小,故错误; ② 加水稀释促进弱酸电离,所以酸分子个数减少,酸根离子个数增大,电离度(α)增大,故正确; ③加水稀释促进弱酸电离,氢离子的物质的量增大,但溶液体积增大的倍数大于氢离子增大的物质的量,溶液氢离子浓度减小,c(OH-)增大,故正确; ④ 温度不变,电离常数不变,故错误; ⑤加水稀释促进弱酸电离,所以酸分子个数减少,酸根离子个数增大,c(A-)/ c(HA)增大,故正确; ⑥加水稀释促进弱酸电离,所以酸分子个数减少,酸根离子个数增大,n(A-)增大,故正确;故选②③⑤⑥;(5)在配制Al2(SO4)3溶液时,Al3+存在水解,水解离子方程式Al3++3H2O
,x:y=19:11;(4)①加水稀释促进弱酸电离,氢离子的物质的量增大,但溶液体积增大的倍数大于氢离子增大的物质的量,溶液氢离子浓度减小,故错误; ② 加水稀释促进弱酸电离,所以酸分子个数减少,酸根离子个数增大,电离度(α)增大,故正确; ③加水稀释促进弱酸电离,氢离子的物质的量增大,但溶液体积增大的倍数大于氢离子增大的物质的量,溶液氢离子浓度减小,c(OH-)增大,故正确; ④ 温度不变,电离常数不变,故错误; ⑤加水稀释促进弱酸电离,所以酸分子个数减少,酸根离子个数增大,c(A-)/ c(HA)增大,故正确; ⑥加水稀释促进弱酸电离,所以酸分子个数减少,酸根离子个数增大,n(A-)增大,故正确;故选②③⑤⑥;(5)在配制Al2(SO4)3溶液时,Al3+存在水解,水解离子方程式Al3++3H2O![]() Al(OH)3+3H+ ,为了防止Al2(SO4)3发生水解,可加入少量的硫酸.(6)该温度下NaHCO3的水解平衡常数HCO3-+H2O
Al(OH)3+3H+ ,为了防止Al2(SO4)3发生水解,可加入少量的硫酸.(6)该温度下NaHCO3的水解平衡常数HCO3-+H2O![]() H2CO3+OH-,Kh=c(H2CO3)c(OH-)/c(HCO3-)=Kw/Ka1=10-14/ 4.0×10-7=2.5×10-8。
H2CO3+OH-,Kh=c(H2CO3)c(OH-)/c(HCO3-)=Kw/Ka1=10-14/ 4.0×10-7=2.5×10-8。

 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
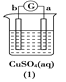
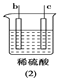
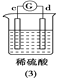
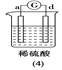
快乐5加2金卷系列答案【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
|
|
|
|
a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A. d>a>b>cB. b>c>d>aC. a>b>c>dD. a>b>d>c
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
0~3 s内,反应速率v(O3)=0.2 mol·L-1·s-1 | 降低温度,平衡常数增大 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D