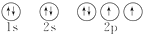题目内容
12.有关核外电子运动规律的描述错误的是( )| A. | 核外电子质量很小,在原子核外绕核作高速运动 | |
| B. | 核外电子的运动规律与普通物体不同,不能用牛顿运动定律来解释 | |
| C. | 在电子云示意图中,通常用小黑点来表示电子绕核作高速圆周运动 | |
| D. | 在电子云示意图中,小黑点越密表示电子在核外空间单位体积内电子出现的概率越大 |
分析 A.电子的质量很小,在原子核外作高速运动;
B.原子核外电子运动不规则;
C.在电子云示意图中,通常用小黑点来表示电子在该点的出现几率;
D.在电子云示意图中,通常用小黑点来表示电子在该点的出现几率,疏密表示出现几率的多少.
解答 解:A.电子的质量很小,是质子质量的$\frac{1}{1836}$,在原子核外作高速运动,且运动不规则,故A正确;
B.原子核外电子运动不规则,所以不能用牛顿运动定律来解释,故B正确;
C.在电子云示意图中,通常用小黑点来表示电子在该点的出现几率而不是表示电子绕核作高速圆周运动的轨迹,故C错误;
D.在电子云示意图中,通常用小黑点来表示电子在该点的出现几率,密的区域表示电子出现的几率大、疏的区域表示电子出现的几率小,故D正确;
故选C.
点评 本题考查了原子核外电子的运动状态及电子云,知道电子云的含义是解本题关键,注意电子云不表示电子的运动轨迹,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.根据高中所学的化学反应原理解答下面的问题:
(1)下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ•mol-1
反应Ⅱ:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.6kJ•mol-1
写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:2CH3OH(g)?CH3CH2OH(g)+H2O(g)△H=-75.6 kJ•mol-1
(2)工业合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H<0.
①该反应在不同温度下的化学平衡常数(K)如下表:
符合表中的平衡常数x的数值是B(填字母序号).
A.0 B.0.012
C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
反应从2min到4min之间,H2的平均反应速率为0.3 mol•L-1•min-1.反应达到平衡时CO的转化率为62.5%.反应在第2min时改变了反应条件,改变的条件可能是AD(填字母序号).
A.使用催化剂 B.降低温度 C.增加H2的浓度 D.升高温度
(3)全钒液流储能电池(VRB)广泛应用于风能、太阳能发电系统的储能系统,电池反应为VO2++V2++2H+ VO2++V3++H2O,试推写出放电时正极的电极反应式VO2++2H++e-=VO2++H2O.
VO2++V3++H2O,试推写出放电时正极的电极反应式VO2++2H++e-=VO2++H2O.
(4)如图2为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况.据图分析:该温度下,溶度积常数的关系为:Ksp[Fe(OH)3]<Ksp[Mg(OH)2](填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是浊液中存在溶解平衡:Mg(OH)2 Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.

(1)下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ•mol-1
反应Ⅱ:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.6kJ•mol-1
写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:2CH3OH(g)?CH3CH2OH(g)+H2O(g)△H=-75.6 kJ•mol-1
(2)工业合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H<0.
①该反应在不同温度下的化学平衡常数(K)如下表:
| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
A.0 B.0.012
C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
| c(CO) | c(H2) | c(CH3OH) | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
A.使用催化剂 B.降低温度 C.增加H2的浓度 D.升高温度
(3)全钒液流储能电池(VRB)广泛应用于风能、太阳能发电系统的储能系统,电池反应为VO2++V2++2H+
 VO2++V3++H2O,试推写出放电时正极的电极反应式VO2++2H++e-=VO2++H2O.
VO2++V3++H2O,试推写出放电时正极的电极反应式VO2++2H++e-=VO2++H2O.(4)如图2为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况.据图分析:该温度下,溶度积常数的关系为:Ksp[Fe(OH)3]<Ksp[Mg(OH)2](填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是浊液中存在溶解平衡:Mg(OH)2
 Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
4. 已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(c)和溶质的质量分数(w)关系是( )
已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(c)和溶质的质量分数(w)关系是( )
 已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(c)和溶质的质量分数(w)关系是( )
已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(c)和溶质的质量分数(w)关系是( )| A. | c和w都不同 | B. | c和w都相同 | C. | c相同,w不同 | D. | w相同,c不同 |
1.下列变化需要加入还原剂才能实现的是( )
| A. | 实验室用H2O2制氧气 | B. | 工业上用氨气制硝酸 | ||
| C. | 实验室用浓HNO3制NO2气体 | D. | 实验室用氯化铵制氨气 |
2.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 推论 |
| A | 含Ag+离子的溶液中滴加氯化钡溶液会产生白色沉淀 | 滴加氯化钡溶液产生白色沉淀的溶液中不一定含有Ag+离子 |
| B | 常温下铜与浓硝酸可以制取NO2 | 常温下铁与浓硝酸也可以制取NO2 |
| C | Fe(OH)3固体中滴加稀盐酸生成氯化铁和水 | Fe(OH)3固体中滴加氢碘酸生成碘化铁和水 |
| D | 铜片不溶于稀硫酸 | 铜片也不溶于稀硝酸 |
| A. | A | B. | B | C. | C | D. | D |
 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)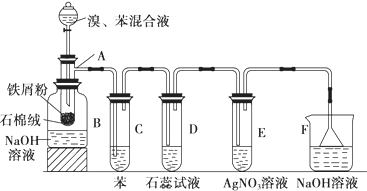
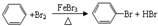 ,该有机反应的类型为取代反应.
,该有机反应的类型为取代反应. 按要求完成下列问题.
按要求完成下列问题.