��Ŀ����
����Ŀ��������ƽ������ƿ����Ͳ�dz�������ѧ��ѧ������������֪��Щ������ʹ���Ƕ����о���ѧ�Ļ�����
(1)���в����У�����ƿ�����߱��Ĺ�����________________ (�����)��
A.����һ�����ȷŨ�ȵı���Һ B.������Һ C.��������ƿ������µ������������Һ D.ȷϡ��ijһŨ�ȵ���Һ E.��ȡһ�������Һ�� F.���������ܽ��������
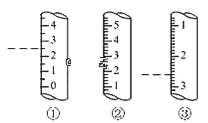
(2)��ͼ��ijЩ�����Ŀ̶Ȳ���ʾ��ͼ��ͼ�и���������Ϊ��ʾ����������Ϊ��Ͳ����_______ (����)������Ϊ_____mL��
(3)ʵ������98%��Ũ��������(Ũ�������1.84g/mL)450mL 0.1 mol��L-1�����ᡣ�ش��������⣺
��������Ӧѡ�õIJ�����������Ͳ���ձ���������������___________��Ӧ��ȡ________mL 98%��Ũ���ᡣ
�ڶ�Ũ����ϡ�������������������ʹ�����Ƶ�����Ũ�ȴ���0.1mol/L��_____(�����)
A.δ����ȴ���Ƚ���Һע������ƿ��
B.ҡ�Ⱥ���Һ����ڿ̶��ߣ��ټ�ˮ���̶���
C.����ƿ��ԭ����������ˮ
D.����ʱ���ӹ۲�Һ��
���𰸡�BCDEF �� 2.6 ��ͷ�ιܡ�500mL����ƿ 2.7 AD
��������
��1������ƿ��Ϊ��������������������һ�����ʵ���Ũ�ȵ���Һ����Ҫ�������������ڴ�����ܽ⡢ϡ�����ʣ�Ҳ���ܲ��������������ݻ���Һ�������
��2����ͼ�и��������Ŀ̶��ص㣬��֪��Ϊ��Ͳ������Ϊ2.6mL��
��3���ٸ���ϡ��ʽ����ͽ��
�ڸ���c=![]() �������жϡ�
�������жϡ�
��1������ƿ��Ϊ��������������������һ�����ʵ���Ũ�ȵ���Һ����Ҫ�������������ڴ�����ܽ⡢ϡ�����ʣ�Ҳ���ܲ��������������ݻ���Һ���������������ƿ���߱��Ĺ����У�BCDEF���ʴ�Ϊ��BCDEF��
��2����ͼ�и��������Ŀ̶��ص㣬��֪��Ϊ��Ͳ������Ϊ2.6mL���ʴ�Ϊ���ڣ�2.6��
��3��������450mL 0.1 mol��L-1��������Һ��ʵ���У�ѡ�õIJ�����������Ͳ���ձ��������������н�ͷ�ιܡ�500mL����ƿ������450mL 0.1 mol��L-1��ϡ���ᣬ��Ҫ500mL������ƿ��98%��Ũ���ᣨ�ܶ�Ϊ1.84g/mL�������ʵ���Ũ��Ϊ![]() mol/L=18.4mol/L��������Ũ�������ΪV������ϡ�Ͷ��ɣ�ϡ��ǰ�����ʵ����ʵ������䣬��500��0.1mol/L=V��18.4mol/L�����V=2.7mL��
mol/L=18.4mol/L��������Ũ�������ΪV������ϡ�Ͷ��ɣ�ϡ��ǰ�����ʵ����ʵ������䣬��500��0.1mol/L=V��18.4mol/L�����V=2.7mL��
��A. δ����ȴ���Ƚ���Һע������ƿ�лᵼ�¶���ʱ��Һ���ƫС��ʹ�����Ƶ�����Ũ�ȴ���0.1mol/L����A��ȷ��
B. ҡ�Ⱥ���Һ����ڿ̶��ߣ��ټ�ˮ���̶��ᵼ�¶���ʱ��Һ���ƫ��ʹ�����Ƶ�����Ũ��С��0.1mol/L����B����
C. ����ƿ��ԭ����������ˮ��ʵ����û��Ӱ�죬��C����
D. ����ʱ���ӹ۲�Һ��ᵼ�¶���ʱ��Һ���ƫС��ʹ�����Ƶ�����Ũ�ȴ���0.1mol/L����D��ȷ��
��ȷ����AD��