题目内容
25℃时,在等体积的①pH=0的H2SO4溶液、②0.05 mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A.1∶10∶1010∶109 B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109 D.1∶10∶104∶109
解析:选A ①pH=0的H2SO4中c(H+)=1.0 mol·L-1,c(OH-)=1.0×10-14 mol·L-1,发生电离的水的浓度为1.0×10-14 mol·L-1。②c(OH-)=0.1 mol·L-1,c(H+)=1.0×10-13mol·L-1,发生电离的水的浓度为1.0×10-13 mol·L-1。③c(OH-)=1.0×10-4mol·L-1,发生电离的水的浓度为1.0×10-4 mol·L-1。④c(H+)=1.0×10-5mol·L-1,发生电离的水的浓度为1.0×10-5mol·L-1。因为各溶液体积相等,故①、②、③、④中发生电离的水的物质的量之比为1.0×10-14∶1.0×10-13∶1.0×10-4∶1.0×10-5=1∶10∶1010∶109,A项正确。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:
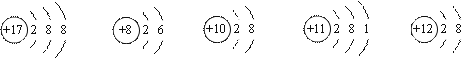 |
A B C D E
(1)属于阴离子结构示意图的是 ▲ (填字母编号)。
(2)性质最稳定的原子是 ▲ (填字母编号)。
(3)元素D的单质在B2中燃烧,该产物的化学式 ▲ 。
(4)在核电荷数1-18的元素内,列举一个与C原子的电子层结构相同的离子,写
出离子的符号 ▲ 。
(5)写出化合物DAB在水溶液中的电离方程式 ▲ 。
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:___________________________
________________________________________________________________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_________________________________________________________________
________________________________________________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO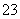 )∶n(HSO
)∶n(HSO )变化关系如下表:
)变化关系如下表:
| n(SO | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:_____________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):________。
a.c(Na+)=2c(SO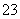 )+c(HSO
)+c(HSO )
)
b.c(Na+)>c(HSO )>c(SO
)>c(SO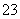 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO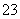 )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)
(4)(201 2·福建高考节选)能证明Na2SO3溶液中存在SO
2·福建高考节选)能证明Na2SO3溶液中存在SO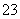 +H2OHSO
+H2OHSO +OH-水解平衡的事实是________(填序号)。
+OH-水解平衡的事实是________(填序号)。
A.滴入酚酞溶液变红 ,再加入H2SO4溶液后红色褪去
,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
人体血液里存在重要的酸碱平衡:CO2+H2OH2CO3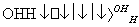 HCO
HCO ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO )∶c(H2CO3)变化关系如下表:
)∶c(H2CO3)变化关系如下表:
| c(HCO | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是( )
A.正常人体血液中,HCO 的水解程度大于电离程度
的水解程度大于电离程度
B.人体血液酸中毒时,可注射NaHCO3溶液缓解
C.pH=7.00的血液中,c(H2CO3)>c(HCO )
)
D.pH=7.40的血液中,HCO 的水解程度一定大于H2CO3的电离程度
的水解程度一定大于H2CO3的电离程度
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
请回答下列问题:
(1)该反应平衡常数表达式为K=______ ;ΔH 0(选填“>”、“<”或“=”)。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,若测得反应初始至6 S内A的平均反应速率v(A)=0.003 mol · L-1· S-1,则6 S时c(A)=______ mol·L-1;C的物质的量为______ mol 。
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为______;如果这时向该密闭容器中再充入1 mol氩气,则平衡时A的转化率_ (选填“增大”、“减小”、“不变”)。
(4)判断该反应是否达到平衡的依据为______(填正确选项的字母)。
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(5)1200 ℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为______ 。
A(g)+B(g)的平衡常数的值为______ 。
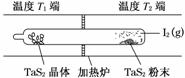
 +H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中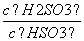 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。