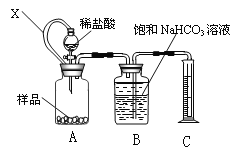
题目内容
【题目】用已知浓度的标准![]() 溶液滴定未知浓度的亚铁溶液,判断以下操作会导致所测亚铁离子浓度偏小的是( )
溶液滴定未知浓度的亚铁溶液,判断以下操作会导致所测亚铁离子浓度偏小的是( )
A.滴定过程中,锥形瓶振荡太剧烈,有少量待测的亚铁溶液溅出
B.读取标准液读数时,滴定前俯视读数,滴定后仰视读数
C.装标准液的滴定管尖嘴部分滴定前有气泡,滴定后无气泡
D.未用标准![]() 溶液润洗滴定管
溶液润洗滴定管
【答案】A
【解析】
根据![]() (其中v表示反应方程式中的计量数)判断,如果某操作引起代入计算的标准液体积偏大,则造成测定结果偏高,反之则偏低。以此解答该题。
(其中v表示反应方程式中的计量数)判断,如果某操作引起代入计算的标准液体积偏大,则造成测定结果偏高,反之则偏低。以此解答该题。
A. 有少量待测的亚铁溶液溅出,则消耗标准液偏少,浓度偏低,故A正确;
B. 读取标准液读数时,滴定前俯视读数,滴定后仰视读数,则标准液体积偏大,浓度偏高,故B错误;
C. 装标准液的滴定管尖嘴部分滴定前有气泡,滴定后无气泡,则标准液体积偏大,浓度偏高,故C错误;
D. 未用标准KMnO4溶液润洗滴定管,标准液浓度偏低,体积偏大,则浓度偏高,故D错误;
答案选A。

 小学课时特训系列答案
小学课时特训系列答案【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
实验方案 | 现象 | 结论 |
步骤1:取4mL①__________ mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
步骤2:取4mL②__________mol/LFeSO4 溶液向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
查阅资料:
已知:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③___________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入3mL0.5mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因___________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应。请用化学平衡移动原理解释溶液由棕色变为黄色的原因_____________________________。
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4