题目内容
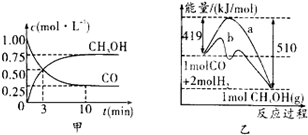
T℃ 时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论正确的是( )
A.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min)
B. 容器中发生的反应可表示为:3X(g)+Y(g)  2Z(g)
2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
【答案】
B
【解析】
试题分析:由图1可知反应进行前3min内,X浓度变化为0.3mol/L,v(X)=0.1mol/(L·min),A错误;由图1可知X减少0.6mol、Y减少0.2mol、Z增加0.4mol,反应方程式为3X(g)+Y(g)  2Z(g),B正确;由图2可知T2>T1,温度高Y百分含量少,说明正反应是吸热反应,升高温度,K增大,C错误;图1和图3起始和平衡时各物质物质的量相同,只是达到平衡需要的时间不同,图3使用了催化剂,不可能是增大压强,若增大压强,平衡发生移动,对应物质的物质的量不可能相同,D错误。
2Z(g),B正确;由图2可知T2>T1,温度高Y百分含量少,说明正反应是吸热反应,升高温度,K增大,C错误;图1和图3起始和平衡时各物质物质的量相同,只是达到平衡需要的时间不同,图3使用了催化剂,不可能是增大压强,若增大压强,平衡发生移动,对应物质的物质的量不可能相同,D错误。
考点: 图像题
点评:解图像题要充分挖掘图像中的信息。

练习册系列答案
相关题目
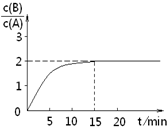 已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)═B(g)+C(g);△H=-48.25kJ?mol-1
反应过程中时间t与A、B浓度有如图关系,若测得第15min时
c(B)=1.6mol?L-1,则下列结论正确的是( )
| A、反应在前15min的平均速率ν(A)=0.11 mol?L-1?min-1 | B、A的初始物质的量为8 mol | C、反应到达平衡的过程中,放出的热量是77.2kJ | D、如使反应最终c(B)/c(A)=1.5,恒温恒容时,加入一定量的A可以实现 |

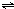 ClO(g)+3H2(g)△H>0.
ClO(g)+3H2(g)△H>0. CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
 I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为: