题目内容
7.A、B、C、D、E均是由下列10种离子组成的5种常见的可溶性化合物(离子不能重复组合).已知:①5种阳离子为:Mg2+、Ba2+、Fe3+、X、Y
②5种阴离子为:OH-、Cl-、CO32-、NO3-、Z
③X是短周期主族元素中金属性最强的元素形成的简单阳离子;Y是简单的阳离子,具有10个电子,且离子半径是10个电子离子中最小的.
(1)元素X的原子结构示意图为
 ;Y离子的电子式为Al3+.
;Y离子的电子式为Al3+.(2)通过所学的知识比较分析,就可判断其中必有的2种物质是Na2CO3和Ba(OH)2(填化学式).
(3)已知Z是常见的多核阴离子,现将(2)中确定的2种物质分别与含Z的溶液混合时,一种产生红褐色沉淀和无色无气味的气体;另一种产生棕黄色沉淀,向该沉淀中滴人足量稀硝酸,沉淀部分溶解,剩余的沉淀为白色.则Z为SO42-.
(4)比较Mg,X,Y三者原子半径从大到小顺序Na>Mg>Al(填元素符号)
(5)将铜片投入到装有D溶液的试管中,铜片不溶解,再滴加稀硫酸,铜片逐渐溶解,试管口附近有红棕色气体出现,写出溶解铜片的离子方程式3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
分析 (1)X是短周期主族元素中金属性最强的元素形成的简单阳离子,则X为Na+;Y是简单的阳离子,具有10个电子,且离子半径是10个电子离子中最小的,则Y为Al3+;
(2)10种离子组成的5种常见的可溶性化合物,CO32-只能与Na+ 形成可溶物,与Mg2+、Ba2+、Fe3+、Al3+ 都有沉淀,所以有Na2CO3,而OH-与Mg2+、Fe3+、Al3+都有沉淀,所以有Ba(OH)2,据此答题;
(3)Z是常见的多核阴离子,根据(2)的分析可知,确定的物质为Na2CO3和Ba(OH)2,它们与含Z的溶液混合时,一种产生红褐色沉淀应为氢氧化铁,和无色无气味的气体应为二氧化碳;另一种产生棕黄色沉淀,向该沉淀中滴人足量稀硝酸,沉淀部分溶解,剩余的沉淀为白色,则棕黄色沉淀应为氢氧化铁和硫酸钡的混合物,所以Z为Fe2(SO4)3;
(4)电子层数相同时,核电荷数越多,半径越小,据此判断;
(5)将铜片投入到装有D溶液的试管中,铜片不溶解,再滴加稀硫酸,铜片逐渐溶解,试管口附近有红棕色气体出现,则说明D中有NO3-,NO3-在酸性条件下与铜反应生成NO,在试管口遇空气中的氧气生成红棕色的二氧化氮,据此写离子方程式.
解答 解:(1)X是短周期主族元素中金属性最强的元素形成的简单阳离子,则X为Na+,Na原子结构示意图为 ,Y是简单的阳离子,具有10个电子,且离子半径是10个电子离子中最小的,则Y为Al3+,Al3+离子的电子式为Al3+,
,Y是简单的阳离子,具有10个电子,且离子半径是10个电子离子中最小的,则Y为Al3+,Al3+离子的电子式为Al3+,
故答案为: ;Al3+;
;Al3+;
(2)10种离子组成的5种常见的可溶性化合物,CO32-只能与Na+ 形成可溶物,与Mg2+、Ba2+、Fe3+、Al3+ 都有沉淀,所以有Na2CO3,而OH-与Mg2+、Fe3+、Al3+都有沉淀,所以有Ba(OH)2,所以必有的2种物质是Na2CO3和Ba(OH)2,
故答案为:Na2CO3和Ba(OH)2;
(3)Z是常见的多核阴离子,根据(2)的分析可知,确定的物质为Na2CO3和Ba(OH)2,它们与含Z的溶液混合时,一种产生红褐色沉淀应为氢氧化铁,和无色无气味的气体应为二氧化碳;另一种产生棕黄色沉淀,向该沉淀中滴人足量稀硝酸,沉淀部分溶解,剩余的沉淀为白色,则棕黄色沉淀应为氢氧化铁和硫酸钡的混合物,所以含Z的物质为Fe2(SO4)3,则Z为SO42-,
故答案为:SO42-;
(4)电子层数相同时,核电荷数越多,半径越小,X为钠,Y为铝,所以Mg,Na,Al三者原子半径从大到小顺序是Na>Mg>Al,
故答案为:Na>Mg>Al;
(5)将铜片投入到装有D溶液的试管中,铜片不溶解,再滴加稀硫酸,铜片逐渐溶解,试管口附近有红棕色气体出现,则说明D中有NO3-,NO3-在酸性条件下与铜反应生成NO,在试管口遇空气中的氧气生成红棕色的二氧化氮,所以溶解铜片的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
点评 本题主要考查了离子共存问题,根据物质的性质进行物质推断是解题的关键,答题时注意化学用语的规范表达,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 101kPa时,能表示H2燃烧热的热化学方程式为:H2(g)+Cl2(g)=2HCl(g);△H=-183kJ/mol | |
| B. | 向Mg(OH)2悬浊液中滴入饱和NH4Cl溶液,沉淀溶解,其离子方程式为:Mg(OH)2+2H+═Mg2++2H2O | |
| C. | 电解精炼铜的阳极反应式为:Cu2++2e-=Cu | |
| D. | 硫代硫酸钠溶液中加入稀硫酸变浑浊:S2O32-+2H+=S↓+SO2↑+H2O |
①H-C≡N ②H2O ③N2 ④H2O2⑤C2H4 ⑥C2H2.
| A. | ①③⑥ | B. | ③④⑤⑥ | C. | ①②③⑥ | D. | ③⑤⑥ |
| A. | CH4的球棍模型示意图为 | B. | 丁烯的键线式为 | ||
| C. | 乙醇的结构式为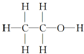 | D. | 乙酸的最简式为CH2O |
| A. | 用碘水可以鉴别葡萄糖溶液和淀粉溶液 | |
| B. | 淀粉、油脂和蛋白质在一定条件下都能发生水解反应 | |
| C. | 工业上利用油脂在碱的催化作用下水解生产肥皂 | |
| D. | 向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
| A. | Mg在空气中燃烧 | B. | 铁丝在氯气中燃烧 | ||
| C. | 足量铜与浓硝酸充分反应 | D. | 足量锌粒与浓硫酸反应得到的气体 |
| A. | 良好的可塑性 | B. | 良好的延展性 | ||
| C. | 良好的导电传热性 | D. | 反应中易失去电子 |
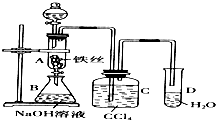 某化学课外小组用右图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中(A下端活塞关闭).(已知此反应属于放热反应;苯和液溴都易挥发)
某化学课外小组用右图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中(A下端活塞关闭).(已知此反应属于放热反应;苯和液溴都易挥发)