题目内容
下列说法合理的是( )
| A、若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B、由水溶液的酸性:HCl>HF,可推断处元素的非金属性越弱,其无氧酸的酸性越强 |
| C、F、Cl、Br、I的氢化物沸点依次升高 |
| D、由两种元素的原子形成的分子中,均只有极性键没有非极性键 |
考点:元素周期律的作用,非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:A、X失电子与Y得电子后电子数相同;
B、不能根据氢化物的酸性来判断非金属性的强弱;
C、HF分子间存在氢键,沸点较高;
D、由两种元素的原子形成的分子中可能存在非极性键.
B、不能根据氢化物的酸性来判断非金属性的强弱;
C、HF分子间存在氢键,沸点较高;
D、由两种元素的原子形成的分子中可能存在非极性键.
解答:
解:A、若X+和Y2-的核外电子层结构相同,则X失电子与Y得电子后电子数相同,所以原子序数:X>Y,故A正确;
B、不能根据氢化物的酸性来判断非金属性的强弱,所以由水溶液的酸性:HCl>HF,不能推断出元素的非金属性越弱,故B错误;
C、HF分子间存在氢键,沸点较高,则Cl、Br、I、F的氢化物沸点依次升高,故C错误;
D、由两种元素的原子形成的分子中可能存在非极性键,如H2O2存在H-O极性键和O-O非极性键,故D错误.
故选A.
B、不能根据氢化物的酸性来判断非金属性的强弱,所以由水溶液的酸性:HCl>HF,不能推断出元素的非金属性越弱,故B错误;
C、HF分子间存在氢键,沸点较高,则Cl、Br、I、F的氢化物沸点依次升高,故C错误;
D、由两种元素的原子形成的分子中可能存在非极性键,如H2O2存在H-O极性键和O-O非极性键,故D错误.
故选A.
点评:本题考查了原子结构、非金属性的判断、氢键、极性键和非极性键,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
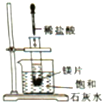 如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.下列说法不正确的是( )
如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.下列说法不正确的是( )| A、试管中有气泡产生 |
| B、烧杯内出现浑浊 |
| C、镁条的化学能大于氢气 |
| D、镁条与稀盐酸的反应为放热反应 |
下列物质的水溶液,加热蒸干得到原物质的是( )
①NaAlO2 ②FeCl3 ③CuSO4 ④FeSO4 ⑤Na2S ⑥Ca(HCO3)2 ⑦NaClO ⑧NH4I ⑨Na2SO3 ⑩CaCl2.
①NaAlO2 ②FeCl3 ③CuSO4 ④FeSO4 ⑤Na2S ⑥Ca(HCO3)2 ⑦NaClO ⑧NH4I ⑨Na2SO3 ⑩CaCl2.
| A、①③⑤⑥⑧⑩ |
| B、②③④⑤⑨⑩ |
| C、①③⑤⑩ |
| D、③⑤⑦⑩ |
在组装原电池时,下列各项中不需要的是( )
| A、电极材料 | B、直流电源 |
| C、电解质溶液 | D、金属导线 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,48g O3含有的氧原子数目为3NA |
| B、2.4g金属镁变为离子时失去电子的数目为0.1NA |
| C、含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
| D、物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数目为NA |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、11.2L O3气体中含有的氧原子数是1.5NA |
| B、含12.0g NaHSO4的水溶液中钠离子数为0.1NA |
| C、1mol OH-中电子数为10NA |
| D、每有1mol Cl2反应转移的电子数一定为2NA |
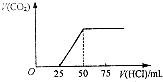 向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体配成溶液逐渐加入盐酸溶液(如图),则原白色固体的成分是( )
向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体配成溶液逐渐加入盐酸溶液(如图),则原白色固体的成分是( )| A、NaOH和Na2CO3 |
| B、Na2CO3 |
| C、Na2CO3和NaHCO3 |
| D、NaHCO3 |
下列物质中,化学键类型和分子空间构型皆相同的是( )
| A、CO2和SO2 |
| B、CH4和SiH4 |
| C、BF3和PH3 |
| D、HCl和NH4Cl |