题目内容
1.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.工业上生产过氧化钙的主要流程如下: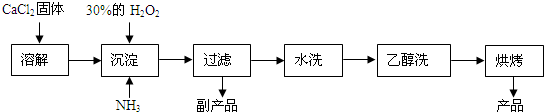
已知CaO2•8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气.
(1)用上述方法制取CaO2•8H2O的化学方程式是CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4Cl;
(2)检验“水洗”是否合格的方法是可取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;
(3)沉淀时常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①温度低可减少过氧化氢的分解,提高过氧化氢的利用率;②该反应是放热反应,温度低有利于提高CaO2•8H2O产率.
(4)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c mol•L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.
已知:I2+2S2O32-=2I-+S4O62-
①CaO2的质量分数为$\frac{36cV×1{0}^{-3}}{a}$ (用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能偏高(填“不受影响”、“偏低”或“偏高”),原因是在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高.
分析 (1)根据图示流程中找出反应物、生成物,写出反应的化学方程式,由工艺流程可知,反应②为氯化钙与氨水、过氧化氢反应生成CaO2•8H2O,还应生成氯化铵;
(2)通过检验洗涤液中是否含有氯离子来判断检验“水洗”是否合格,用稀硝酸酸化的硝酸银溶液检验;
(3)从双氧水的稳定性、该反应的反应热、温度对过氧化钙的溶解度的影响等方面分析;
(4)①根据电子守恒及化学反应方程式找出过氧化钙与硫代硫酸钠反应的关系式,再根据题中数据计算出样品中过氧化钙的质量分数;
②根据空气中的氧气能够氧化碘离子,使碘单质的量增加,消耗的硫代硫酸钠增加分析.
解答 解:(1)由流程可知,反应物为氯化钙、双氧水、氨气和水,生成为CaO2•8H2O和氯化铵,反应的化学方程式为:CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4Cl,
故答案为:CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4Cl;
(2)“水洗”若不合格,洗涤液中会含有氯离子,所以检验“水洗”是否合格的方法是:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀,
故答案为:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;
(3)由于温度较高时双氧水容易分解,会导致过氧化钙产率下降,且温度降低时过氧化钙的溶解度减小,有利于过氧化钙的析出,该反应是放热反应,温度低有利于提高CaO2•8H2O产率,所以沉淀反应时常用冰水浴控制温度在0℃左右,
故答案为:温度低可减少过氧化氢的分解,提高过氧化氢的利用率;该反应是放热反应,温度低有利于提高CaO2•8H2O产率;
(4)①过氧化钙氧化碘化钾生成的碘单质,用硫代硫酸钠滴定时,消耗的硫代硫酸钠的物质的量为:cmol•L-1×V×10-3L=cV×10-3mol,根据氧化还原反应中电子守恒及题中反应方程式可得关系式:CaO2~I2~2S2O32-,过氧化钙的物质的量为:n(CaO2)=$\frac{1}{2}$n(S2O32-)=$\frac{1}{2}$×cV×10-3mol,
样品中CaO2的质量分数为:$\frac{\frac{1}{2}×cV×1{0}^{-3}mol×72g/mol}{ag}$=$\frac{36cV×1{0}^{-3}}{a}$;
故答案为:$\frac{36cV×1{0}^{-3}}{a}$;
②在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高,
故答案为:偏高;在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高.
点评 本题考查形式为物质制备流程图题目,涉及中和滴定中的误差分析、物质的检验及化学计算等问题,题目难度较大,做题时注意分析题中关键信息、明确实验基本操作方法,本题较为综合,充分考查了学生的分析、化学实验、化学计算能力.

| A. | 0.1mol/L CH3COONa溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | Na2CO3溶液加水稀释后,恢复至原温度,pH增大和KW不变 | |
| C. | 一定温度下,pH=6的HCl溶液和pH=6的NH4Cl溶液中,c(H+)相等 | |
| D. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)不变化 |
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
①B溶液分别与C、D混合,均有白色沉淀生成;
②将A溶液逐滴滴入C溶液中,有沉淀生成,继续滴加A溶液时,沉淀减少直至完全消失;
③A与D两种固体混合加热有气体生成,该气体能使湿润的红色石蕊试液变蓝;
④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体.
(1)A所含的阴离子的电子式是
 ,B所含的阳离子是Ba2+.
,B所含的阳离子是Ba2+.(2)C的化学式是Al2(SO4)3,D的化学式是(NH4)2CO3.
(3)写出②中沉淀溶解的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
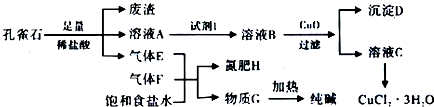
且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如表所示.回答下列问题:
(1)图中“试剂1”为C12或H2O2.
(2)加入CuO作用是调节溶液pH,则pH的范围为3.2≤pH<4.7.
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
(4)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤等操作.
(5)已知:常温下Cu(OH)2的Ksp=2×10-20.计算Cu2++2H2O?Cu(OH)2+2H+反应平衡常数5×10-9.
| A. | 向FeSO4溶液中加入少量Na2O2:4Na2O2+6H2O+4Fe2+═4Fe(OH)3↓+8Na++O2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至沉淀的质量最大:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 向NaClO溶液中通入少量SO2: 2ClO-+SO2+H2O═2HClO+SO32- | |
| D. | 将0.2 mol/L的NH4Al(SO4)2溶液与0.4 mol/L的Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═Al(OH)3↓+2BaSO4↓+NH3•H2O |
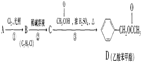 )对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业.它有很多同分异构体,其中含有酯基和一取代苯结构的同分异构体有五个,请写出其结构简式:
)对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业.它有很多同分异构体,其中含有酯基和一取代苯结构的同分异构体有五个,请写出其结构简式: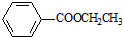 、
、 、
、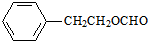 、
、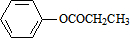 、
、 .
.
 .
.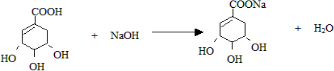 .
. -COOH),其反应类型是c
-COOH),其反应类型是c
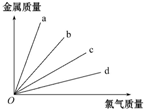 如图所示,钠、镁、铝、铁分别跟足量的氯气反应时,消耗金属的质量与反应的氯气的质量之间的关系,其中表示铝与氯气反应的是( )
如图所示,钠、镁、铝、铁分别跟足量的氯气反应时,消耗金属的质量与反应的氯气的质量之间的关系,其中表示铝与氯气反应的是( )