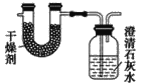
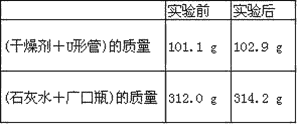
题目内容
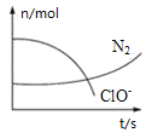
【题目】某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO- 和N2的物质的量随时间的变化如下图所示。有关判断正确的是
A.氧化剂是ClO-,还原产物是HCO3-
B.反应体系中反应物与生成物各有三种微粒
C.氧化剂与还原剂的物质的量之比为5∶2
D.生成2.24L N2(标准状况)时转移电子0.5 mol
【答案】BC
【解析】
由曲线变化图可知,随反应进行![]() 的物质的量降低,
的物质的量降低,![]() 的物质的量增大,故C
的物质的量增大,故C![]() 为反应物,
为反应物,![]() 是生成物,根据电子转移相等可知,
是生成物,根据电子转移相等可知,![]() 是反应物,由氯元素守恒可知
是反应物,由氯元素守恒可知![]() 是生成物,由碳元素守恒可知
是生成物,由碳元素守恒可知![]() 是生成物,由氢元素守恒可知
是生成物,由氢元素守恒可知![]() 是反应物.反应中Cl元素化合价由
是反应物.反应中Cl元素化合价由![]() 价降低为
价降低为![]() 价,化合价总共降低2价,C元素化合价由
价,化合价总共降低2价,C元素化合价由![]() 价升高为
价升高为![]() 价,N元素化合价由
价,N元素化合价由![]() 价升高为0价,化合价总共升高
价升高为0价,化合价总共升高![]() 价,故C
价,故C![]() 系数为2,
系数为2,![]() 系数为5,由元素守恒可知
系数为5,由元素守恒可知![]() 系数为2,
系数为2,![]() 系数为1,
系数为1,![]() 系数为5,
系数为5,![]() 系数为1,反应方程式为
系数为1,反应方程式为![]() 。
。
A.反应中Cl元素化合价由![]() 中
中![]() 价降低为
价降低为![]() 中
中![]() 价,
价,![]() 是氧化剂,还原产物是
是氧化剂,还原产物是![]() ,A错误;
,A错误;
B.由![]() 可知,B正确;
可知,B正确;
C.由上述分析可知,反应为![]() ,反应中是
,反应中是![]() 是还原剂,
是还原剂,![]() 是氧化剂,氧化剂与还原剂的化学计量数之比为5:2,C正确;
是氧化剂,氧化剂与还原剂的化学计量数之比为5:2,C正确;
D.![]() 标准状况
标准状况![]() 的物质的量为
的物质的量为![]() ,所以参加反应的
,所以参加反应的![]() 的物质的量为
的物质的量为![]() ,反应中只有氯元素化合价降低,由
,反应中只有氯元素化合价降低,由![]() 中
中![]() 价降低为
价降低为![]() 中
中![]() 价,所以转移电子数为
价,所以转移电子数为![]() ,D错误。
,D错误。
故选BC。

练习册系列答案
相关题目