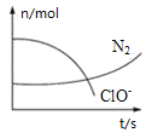
��Ŀ����
����Ŀ������������ɫ���ӷ���Һ�壬�ڻ���������;�㷺��ʵ����ģ��һ�ֹ�ҵ�Ʊ����������Ҫ�������£�
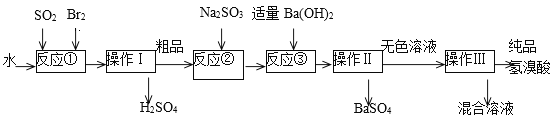
��1��д����Ӧ�ٵ����ӷ���ʽ___________�÷�Ӧ��Ҫ�ڱ�ˮԡ�н��У����ܵ�ԭ����____________��
��2������I������__________��
��3����Ӧ����Na2SO3��Ŀ����_____________________��
��4���������õ��IJ����������ձ���_____________________��
��5����ҵ�������Ƶõ���������е����Ļ�ɫ�����Ǽ�����ͬѧ�����ʵ�����̽����
�ټ�ͬѧ���蹤ҵ������ʵ���ɫ����Ϊ��Fe3����������֤���ü������õ��Լ�Ϊ_________������������ɹ۲쵽������Ϊ____________________��
����ͬѧ���蹤ҵ������ʵ���ɫ����Ϊ____��������֤���ü�������ķ���Ϊ________________��
���𰸡�SO2+Br2+2H2O=SO42��+2Br��+4H+ ��ֹBr2��HBr�ӷ� ���� ��ȥ��Ʒ�е��� ��������©�� KSCN ȡ�����μ�KSCN��Һ������Һ��Ϊ��ɫ����֤����Fe3�� Br2�����壩 ȡ��������CCl4��������������Ͳ�ʳ�ɫ���Ⱥ�ɫ��֤����Br2
��������
���̷�Ӧ�Ң��з�����Ӧ SO2+Br2+2H2O=H2SO4+2HBr��������������������������Ĵ�Ʒ�����壩����Ӧ�Ң��м���Na2SO3��ԭ��Ʒ�е�Br2�����ᷴӦ����SO42- ����������������˵����ᱵ��������ɫ��Һ��������õ���Ʒ�����ᡣ
(1)Br2����ǿ�����ԣ�����Һ�н�SO2����ΪH2SO4����������ԭΪHBr��Br2����SO2�ų��ܶ�������Br2��HBr�ӷ���
(2)�ɹ������̿�֪��������Ϊ���ܵ���Һ��ֵķ��룬Ӧ������
(3)��Ʒ�п��ܺ���Ϊ��Ӧ��Br2��Ӧ��ȥBr2��
(4)������������Һ���壬�ò����ǹ��ˣ����ݹ��˲����ķ����ж�ʹ�õ�������
(5) ����KSCN��Һ����Fe3+���μ�KSCN��Һ����Һ���Ѫ��ɫ��
���ɹ������̿�֪����Һ�п��ܺ���Br2��������CCl4��ȡ�������顣
(1)Br2����ǿ�����ԣ�����Һ�н�SO2����ΪH2SO4����������ԭΪHBr����Ӧ�����ӷ���ʽΪ��SO2+Br2+2H2O=SO42-+2Br-+4H+��Br2����SO2�ų��ܶ�������Br2��HBr�ӷ���ʹ�ñ�ˮ��������ϵ�¶ȣ���ֹBr2��HBr�ӷ���ʹ��Ӧ��ȫ���ʴ�Ϊ��SO2+Br2+2H2O=SO42-+2Br-+4H+����ֹBr2��HBr�ӷ���
(2)�ɹ������̿�֪��������Ϊ���ܵ���Һ��ֵķ��룬Ӧ�����ʴ�Ϊ������
(3)��Ʒ�п��ܺ���Ϊ��Ӧ��Br2������Na2SO3����ȥ��Ʒ��δ��Ӧ����壬�ʴ�Ϊ����ȥ��Ʒ�е��壻
(4)������������Һ���壬�ò����ǹ��ˣ��õ��IJ����������ձ�����������©�����ʴ�Ϊ����������©����
(5)����KSCN��Һ����Fe3+��������ȡ������Һ�μ�KSCN��Һ����Һ���Ѫ��ɫ��˵��������ʵ���ɫ����Ϊ��Fe3+���ʴ�Ϊ��KSCN��ȡ�����μ�KSCN��Һ������Һ��Ϊ��ɫ����֤����Fe3����
���ɹ������̿�֪����Һ�п��ܺ���Br2��֤���ü�������ķ������ý�ͷ�ι�ȡ�Ƶõ����������Թ��У��μ�CCl4������ֹ���²�ʳȺ�ɫ��֤����Br2���Ի�ɫ���ʴ�Ϊ��Br2�����壩��ȡ��������CCl4��������������Ͳ�ʳ�ɫ���Ⱥ�ɫ��֤����Br2��

 ������״Ԫ���Ծ�ϵ�д�
������״Ԫ���Ծ�ϵ�д�