题目内容
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不相等的是(填序号)_______。
A.C7H12O2 B.C6H14 C.C6H14O D.C7H14O3
(2)若烃A为链烃,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种。
①A的结构简式为______________;名称是______________________。
②A在一定条件下能发生加聚反应,写出该反应的化学方程式_____________________。
(3)若核磁共振氢谱显示链烃A中有三个峰,且峰面积比为3:2:1,写出A所有可能的结构简式____。
【答案】B 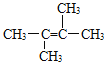 2,3-二甲基-2丁烯 n
2,3-二甲基-2丁烯 n
![]()
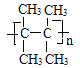 CH3-CH2-CH=CH-CH2-CH3、CH2=C(CH2CH3)2
CH3-CH2-CH=CH-CH2-CH3、CH2=C(CH2CH3)2
【解析】
(1)先用商余法确定A的分子式,然后看1molA消耗的O2的物质的量,将烃及烃的含氧衍生物通式可知CxHyOz,若总物质的量一定,若各组分耗氧量(x+![]() )相等,则消耗氧气的量相等,否则不相等,对各个选项注意分析判断;
)相等,则消耗氧气的量相等,否则不相等,对各个选项注意分析判断;
(2)若烃A为链烃,应含有一个碳碳双键,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种说明分子结构对称,该分子的一氯取代物只有一种,说明A分子中只有一种H原子;
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,说明分子中含有3种不同位置的H原子,结合分子中H原子数目确定分子结构;
某烃A的相对分子质量为84,则烃中C原子最大数目=84÷12=7,故有机物分子式为C6H12。
(1)1mol C6H12的耗氧量=(6+3)mol=9mol,若各组分耗氧量(x+![]() )相等,则消耗氧气的量相等,否则不相等。
)相等,则消耗氧气的量相等,否则不相等。
A.1molC7H12O2的耗氧量=(7+3-1)mol=9mol;
B.1molC6H14的耗氧量=(6+![]() )mol=9.5mol;
)mol=9.5mol;
C.1molC6H14O的耗氧量=(6+![]() )mol=9mol;
)mol=9mol;
D.1molC7H14O3的耗氧量=(7+![]() )mol=9mol;
)mol=9mol;
可见等物质的量的C6H12与C6H14的耗氧量不相等,故合理选项是B;
(2)若烃A为链烃,应含有一个碳碳双键,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种说明分子结构对称,该分子的一氯取代物只有一种,说明A分子中只有一种H原子,符合题意的A结构简式为 ,该物质的名称为2,3-二甲基-2丁烯;
,该物质的名称为2,3-二甲基-2丁烯;
该分子中含有碳碳双键,在一定条件下发生加聚反应,反应方程式为:
n
![]()
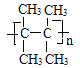 ;
;
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,说明分子中含有3种不同位置的H原子,结合分子中H原子数目确定分子结构;则H原子数目分别为6、4、2,则A为CH3-CH2-CH=CH-CH2-CH3,也可能为CH2=C(CH2CH3)2。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案