题目内容
(14分)实验为测定一新配制的稀盐酸的准确浓度,通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取w g无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,为准确起见,滴定终点宜选择在pH 4~5之间,则在中学学过的几种指示剂应选_______________,当滴定溶液由_____色变成_____色时,即表示达滴定终点.
(2)若滴到终点时,中和w g Na2CO3消耗盐酸V mL,则盐酸的物质的量浓度为________mol·L—1。
(3)若所称取的Na2CO3不纯,测得盐酸的浓度就不准确。现设盐酸的准确浓度为c1mol·L-1,用不纯的Na2CO3标定测得盐酸为c2mol·L-1,在下述情况下,c1,c2的关系是 (空填>、<或=)
①当Na2CO3中含有NaHCO3时,cl_____c2;
②当Na2CO3中含有NaOH时,cl_____c2;
③当Na2CO3中含有Na2CO3·10H2O时,cl_____c2。
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,为准确起见,滴定终点宜选择在pH 4~5之间,则在中学学过的几种指示剂应选_______________,当滴定溶液由_____色变成_____色时,即表示达滴定终点.
(2)若滴到终点时,中和w g Na2CO3消耗盐酸V mL,则盐酸的物质的量浓度为________mol·L—1。
(3)若所称取的Na2CO3不纯,测得盐酸的浓度就不准确。现设盐酸的准确浓度为c1mol·L-1,用不纯的Na2CO3标定测得盐酸为c2mol·L-1,在下述情况下,c1,c2的关系是 (空填>、<或=)
①当Na2CO3中含有NaHCO3时,cl_____c2;
②当Na2CO3中含有NaOH时,cl_____c2;
③当Na2CO3中含有Na2CO3·10H2O时,cl_____c2。
(1)甲基橙 黄色 橙色
(2)(w×103)/(53×V)
(3)①< ② > ③ <
(2)(w×103)/(53×V)
(3)①< ② > ③ <
试题分析:(1)因为滴定终点的pH在 4~5之间,所以应该选择在酸性变色的指示剂,因此用甲基橙做指示剂,当达到滴定终点时溶液有黄色变为橙色。
(2)盐酸的浓度为
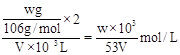 。
。(3)根据
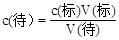 ,当Na2CO3中含有NaHCO3时,消耗的Na2CO3的体积比正常值大,所以c1<c2。当Na2CO3中含有NaOH时,消耗的Na2CO3的体积比正常值小,所以c1>c2。当Na2CO3中含有Na2CO3·10H2O时,消耗的Na2CO3的体积比正常值大,所以c1<c2。
,当Na2CO3中含有NaHCO3时,消耗的Na2CO3的体积比正常值大,所以c1<c2。当Na2CO3中含有NaOH时,消耗的Na2CO3的体积比正常值小,所以c1>c2。当Na2CO3中含有Na2CO3·10H2O时,消耗的Na2CO3的体积比正常值大,所以c1<c2。点评:在选择指示剂时,要根据生成物质的酸碱性选择合适的指示剂。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
 Cu2++2OH-,Ksp=c(Cu2+)·c2(OH-)=2×10-20。当溶液中各种离子的浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
Cu2++2OH-,Ksp=c(Cu2+)·c2(OH-)=2×10-20。当溶液中各种离子的浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。 Cr(OH)3
Cr(OH)3 CrO22- + H+ + H2O
CrO22- + H+ + H2O