题目内容
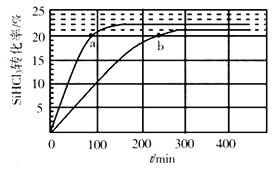
【题目】在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)![]() CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如下图所示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线。请按要求回答下列问题:
CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如下图所示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线。请按要求回答下列问题:
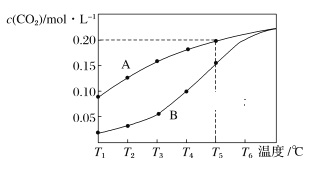
(1)该反应正反应为______(填“吸”或“放”)热反应,温度为T5℃时,该反应耗时40s达到平衡,则T5℃时,该反应的平衡常数数值为________。
(2)如果该反应的平衡常数K值变大,该反应________(选填字母)。
a.一定向逆反应方向移动
b.在平衡移动时正反应速率先增大后减小
c.一定向正反应方向移动
d.在平衡移动时逆反应速率先减小后增大
(3)保持温度、体积不变,充入CO2气体,则CaCO3的质量______,CaO的质量______CO2的浓度________(填“增大”,“减小”或“不变”)。
【答案】吸 0.2 mol/L bc 增大 减小 不变
【解析】
(1)由图象可知,随着温度的升高,二氧化碳的平衡浓度增大,说明平衡向正反应方向移动,所以该反应为吸热反应,根据化学反应方程式可知,平衡常数K=c(CO2),所以T5℃时,K=c(CO2)=0.2mol/L;
(2)平衡常数增大,说明平衡正向移动,此时改变的条件为升高温度,如果该反应的平衡常数K值变大,则:
a.一定向正反应方向移动,选项a错误;
b.在平衡移动时,由于是升高温度,所以正反应速率增大,由于该反应是吸热反应,升温平衡正向移动,所以正反应速率又逐渐减小,选项b正确;
c.一定向正反应方向移动,选项c正确;
d.根据b的分析可知,由于是升高温度,所以逆反应速率也增大,选项d错误;
答案选bc;
(3)保持体积、温度不变,充入CO2气体,平衡逆向移动,则CaCO3的质量增大,CaO的质量减小,根据平衡常数K=c(CO2)可知,温度不变,平衡常数不变,则CO2的浓度不变。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料。实验室可用苯甲醛和乙酸酐、醋酸钠等原料经下列反应制取肉桂酸,其中苯甲醛为无色油状液体。已知:
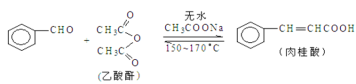 +CH3COOH
+CH3COOH
苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
溶解度(25℃,g/100g水) | 0.3 | 遇水易水解成乙酸 | 0.04 | 互溶 |
沸点(℃) | 179.6 | 138.6 | 300 | 118 |
相对分子质量 | 106 | 102 | 148 | 60 |

填空:
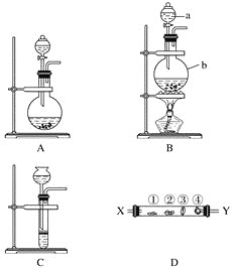
Ⅰ.合成:反应装置如图所示。向三颈烧瓶中先后加入研细的无水醋酸钠、3.6 g苯甲醛和4.2 g乙酸酐,振荡使之混合均匀。在150~170℃加热1小时,保持微沸状态。
(1)仪器A的名称为________,其作用是__________。
(2)该装置加热要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是(从平衡移动角度解释)_________。
(3)不能把无水CH3COONa换成CH3COONa·3H2O的原因是_________。
Ⅱ.粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:在搅拌下,向反应液中加入20 mL水
A.再慢慢加入碳酸钠溶液
B.然后进行水蒸气蒸馏(已知水蒸气蒸馏是分离提纯有机化合物的重要方法之一,可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的)
C.待烧瓶内溶液冷却至室温,在搅拌下用加入盐酸酸化,析出大量晶体,过滤,洗涤,干燥。
(4)饱和Na2CO3溶液的作用有_______。水蒸气蒸馏除去的杂质是______。
(5)若得到的肉桂酸晶体产品不纯,应采用____方法可得到纯度更高的产品。
(6)若最后得到纯净的肉桂酸4.3 g,则该反应中的产率是____(保留小数点后一位)。
【题目】在3个体积均为2.0 L的恒容密闭容器中,反应CO2(g)+C(s)![]() 2CO(g)ΔH>0,分别在一定温度下达到化学平衡状态。下列说法正确的是
2CO(g)ΔH>0,分别在一定温度下达到化学平衡状态。下列说法正确的是
容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
I | 977 | 0.28 | 0.56 | 0 | 0.4 |
II | 977 | 0.56 | 0.56 | 0 | x |
III | 1250 | 0 | 0 | 0.56 | y |
A.977K,该反应的化学平衡常数值为2
B.达到平衡时,向容器I中增加C的量,平衡正向移动
C.达到平衡时,容器Ⅰ中CO2的转化率比容器Ⅱ中的大
D.达到平衡时,容器Ⅲ中的CO的转化率大于28.6%