题目内容
8.向密闭容器中充入1.0mol CO和2.0mol H2O(g)发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).当反应达到平衡时,CO的体积分数为x.若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数小于x的是( )| A. | 0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2 | |
| B. | 0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2 | |
| C. | 0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2 | |
| D. | 1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2 |
分析 根据等效平衡解答,恒温恒容下,该反应前后气体体积不发生变化,将物质全部转化到左边满足n(CO):n(H2O)=1:2,为等效平衡,平衡时CO的体积分数相同,不同配比达到平衡时CO的体积分数小于原平衡中CO的体积分数X,说明不同配比全部转化到左边应n(CO):n(H2O)<1:2,据此解答.
解答 解:A、采用极限分析法,0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2,假如反应完全转化为CO和H2O物质的量为:0.9mol:1.9mol<1:2,故A符合;
B、采用极限分析法,0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2,假如反应完全转化为CO和H2O物质的量为:1.5mol:3mol=1:2,反应前后气体体积不变,平衡相同,CO的体积分数为x,故B不符合;
C、采用极限分析法,0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mo H2,假如反应完全转化为CO和H2O物质的量为1mol:2mol=1:2,当反应达到平衡时,CO的体积分数为x,故C不符合;
D、采用极限分析法,1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2,假如反应完全转化为CO和H2O物质的量为:2mol:2mol=1:1>1:2,故D不符合;
故选A.
点评 本题考查了化学平衡的影响因素分析,等效平衡的应用判断,极值转化是解题的关键,题目难度中等.

练习册系列答案
相关题目
3.向盛有氯化铁溶液的烧杯中加入过量的铜粉,反应结束后,溶液中大量存在的金属离子是( )
| A. | Cu2+ Fe2+ | B. | Fe2+Fe3+ | C. | Fe3+ Cu2+ | D. | 只有Fe2+ |
13.向AlCl3溶液中逐滴加入NaOH溶液至过量,反应中可以观察到的现象是( )
| A. | 产生白色沉淀,继而沉淀溶解 | B. | 只放出气体 | ||
| C. | 生成白色沉淀,且不消失 | D. | 既生成白色沉淀又放出气体 |
20.下列分类标准不正确的是( )
| A. | 化合物分为:电解质、非电解质(标准:溶于水或熔融状态能否导电) | |
| B. | 分散系分为:溶液、胶体、浊液(标准:分散质粒子的大小) | |
| C. | 化学反应分为:氧化还原反应、非氧化还原反应(标准:元素化合价是否发生变化) | |
| D. | 化学反应分为:离子反应、非离子反应(标准:是否在水溶液中进行) |
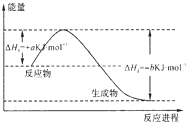
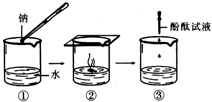 钠、铁和铝是三种重要的金属.请回答:
钠、铁和铝是三种重要的金属.请回答: