题目内容
某离子反应中涉及H2O、ClO—、NH4+、H+、N2、Cl—六种微粒。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是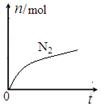
| A.该反应的还原剂是Cl— |
| B.消耗1 mol还原剂,转移6 mol电子 |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
D
解析试题分析:由题意知,反应离子方程式2NH4++3ClO—=3Cl—+N2+2H++3H2OA、还原剂发生氧化反应化合价升高,溶液中N2浓度增大,即N2为生成物,NH4+为还原剂,故A错误;B、由题意知每消耗1mol NH4+生成0.5mol N2,转移电子3mol,故B错误;C、氧化剂与还原剂的物质的量之比为3:2;D、反应后生成氢离子,即溶液酸性明显增强,故D正确。
考点:氧化还原反应的计算

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
某国外化学教材中有一张关于氧化还原反应的插图:由图可知,在该反应中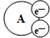 是
是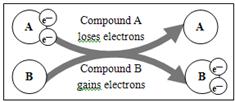
| A.还原剂 | B.氧化剂 | C.氧化产物 | D.还原产物 |
化学工业是国民经济的支柱产业,下列生产过程中不涉及氧化还原反应的是
| A.氮肥厂用氮气和氢气合成氨气 | B.硝酸厂用氨氧化法制硝酸 |
| C.从海水中提溴 | D.纯碱厂用NaCl、NH3、CO2等制纯碱 |
下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是( )
| A.浓硫酸的质量增加 | B.铝的表面生成致密的氧化物薄膜 |
| C.澄清的石灰水变浑浊 | D.氢氧化钠固体发生潮解 |
下列叙述正确是的
| A.人工固氮的过程一定涉及到氧化还原反应 |
| B.1mol氯气在反应中一定得到2mol电子 |
| C.1mol钠在足量氧气中燃烧生成Na2O2,失去2mol电子 |
| D.发生化学反应时,失去电子越多的金属原子,还原能力越强 |
把一定质量的铁完全溶解于某浓度的硝酸中收集到0.3 mol NO2和0.2 mol NO。向反应后的溶液中加入足量NaOH溶液充分反应,经过滤、洗涤后,把所得沉淀加热至质量不再减少为止。得到固体质量不可能为
| A.18 g | B.24 g | C.30 g | D.36 g |
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可产生它。下列有关叙述中错误的是
| A.“某物质”具有还原性 |
| B.CuH与盐酸反应,可能产生H2 |
| C.CuH与足量的稀硝酸反应:CuH+ 3H++ NO3-→ Cu2++ NO↑+ 2H2O |
| D.CuH在氯气中燃烧:CuH+ Cl2→ CuCl+ HCl |
高铁酸钠(Na2FeO4)是一种新型、高效、多功能的水处理剂。湿法制备的离子反应方程式: 2Fe(OH)3+3ClO-+4OH-→ 2FeO42-+3Cl-+5H2O;干法制备化学反应方程式:2FeSO4+4Na2O2→2Na2FeO4+2Na2SO4。有关分析错误的是
| A.等物质的量Na2FeO4氧化能力优于次氯酸钠 |
| B.湿法中氢氧化铁被氧化 |
| C.干法中每生成1 mol Na2FeO4转移3 mol电子 |
| D.高铁酸钠的氧化性大于次氯酸钠 |
根据表中信息判断,下列选项不正确的是
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2+… |
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2