��Ŀ����
����Ŀ��������ҵ�ǹ��ҹ�ҵ��֧����ÿ����������ù�����ʧ�����ʽ���ش������ʴ����������е��й����⡣��ʵ�������У����������ı����ͭ��ֹ������ʴ��װ��ʾ��ͼΪ��
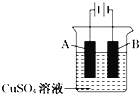
(1)A�缫��Ӧ�Ľ�����________(дԪ������)��B�缫�ĵ缫��Ӧʽ��________��
(2)�����ǰ����ͭ��Ƭ����������ͬ�������ɺ�����ȡ��ϴ������ɡ�����������������Ϊ5.12g������ʱ��·��ͨ���ĵ���Ϊ________��
(3)�Ʋ������ͭ���ȶ�п�������ױ���ʴ�����Ҫ˵��ԭ��________
���𰸡�ͭ Cu2++2e���TCu 0.08 ����ͭ���ã��Ʋ��ƻ����ڳ�ʪ�������γ�ԭ��أ���Ϊ�������������ĸ�ʴ
��������
��1�����ʱ���Ʋ����������Ƽ��������������ϵõ��ӷ�����ԭ��Ӧ��
��2��������ͭʧ���ӷ���������Ӧ��������ͭ���ӵõ��ӷ�����ԭ��Ӧ�������ǰ����ͭ��Ƭ����������ͬ�������ɺ����������Ϊ5.12g�������������һ��Ϊ����������ͭ������ͭ��ת�Ƶ���֮��Ĺ�ϵʽ���㣻
��3����ԭ��ظ��������ױ���ʴ����ԭ������������ױ�������
��1�����ʱ���Ʋ�ͭ���������Ƽ���������������A��ͭ��B������������ͭ���ӵõ�������ͭ���缫��ӦʽΪCu2++2e���TCu,�ʴ�Ϊ:ͭ; Cu2++2e���TCu��
��2��������ͭʧ���ӷ���������Ӧ��������ͭ���ӵõ��ӷ�����ԭ��Ӧ�������ǰ����ͭ��Ƭ����������ͬ�������ɺ����������Ϊ5.12g�������������һ��Ϊ����������ͭ����ת�Ƶ��ӵ����ʵ����� =0.08mol���ʴ�Ϊ��0.08��
=0.08mol���ʴ�Ϊ��0.08��
��3��п�����͵������Һ����ԭ���ʱ��п��ʧ����������������������������ͭ�����͵������Һ����ԭ���ʱ������ʧ��������������ʴ�����Զ�ͭ���ȶ�п�������ױ���ʴ���ʴ�Ϊ:����ͭ���ã��Ʋ��ƻ����ڳ�ʪ�������γ�ԭ��أ���Ϊ�������������ĸ�ʴ��

 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д� Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д� Сѧ��ĩ���100��ϵ�д�
Сѧ��ĩ���100��ϵ�д�����Ŀ����������ʵ�����������ó��Ľ�����ȷ����( )
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ������ | ������ʹʪ�����ɫʯ����ֽ��� | �ȴ�����ˮ�е���� |
B | ���������ᴦ���� | �����ɳ�ɫ��Ϊ��ɫ | �Ҵ����������� |
C | �� | ������ɫ���� | ������������� |
D | ����������ȼ�ճ��е�ȼ��Ѹ�����뼯�� | �����������̣�ƿ���к�ɫ�������� |
|
A.AB.BC.CD.D
����Ŀ����֪2SO2��g��+O2��g��2SO3��g����H=��197kJmol��1������ͬ��ʽ��ס��Һͱ�3����ͬ������Ͷ�뷴Ӧ��ұ��ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й����������
���� | �� | �� | �� |
��Ӧ��Ͷ���� | 2molSO2��1molO2 | 1molSO2��0.5molO2 | 2molSO3 |
ƽ�ⳣ�� | K1 | K2 | K3 |
��Ӧ�������仯 | �ų�akJ | �ų�bkJ | ����ckJ |
�����ܶ� | ��1 | ��2 | ��3 |
��Ӧ��ת���� | ��1 | ��2 | ��3 |
�����йع�ϵʽ��ȷ���ǣ� ��
A. K1=K3��K2 B. ��1=��3����2 C. ��2+��3��1 D. 2b+c��197