题目内容
Ⅰ.工业上用铝土矿制取铝的流程如下: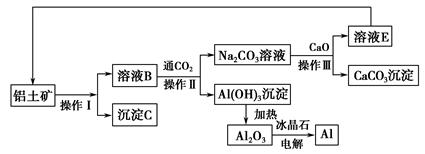
请回答下列问题:
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ都用到的玻璃仪器有__________________________。
(2)写出由溶液B生成Al(OH)3的离子方程式:____________________________。
(3)工艺流程中涉及氧化还原反应的化学方程式为:_________________________。
(4)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
Ⅱ.我国高炉生产各方面取得了显著进步,但在资源和能源利用率、高炉大型化、提高产业集中度以及环保等方面还跟国际存在很大差距,有待进一步提高,努力向钢铁强国迈进。请回答下列问题:
(1)高炉炼铁的原料有铁矿、焦炭和石灰石,其中起熔剂作用的是________,目的是除去铁矿石中的脉石,其产物密度比铁________,所以在铁水的________(填“上部”或“下部”)形成炉渣而与铁水分离。
(2)焦炭在高炉炼铁中起着举足轻重的作用,下列不属于焦炭作用的是________。
A.作为燃料,为炼铁中的化学反应提供能量
B.作为还原剂与二氧化碳反应产生还原氧化铁的一氧化碳
C.对高炉中的物料起到支撑和疏散的作用
D.作为溶剂,除去铁矿石中的杂质
(3)高炉炼铁的污染非常严重,目前我国部分大城市中的钢铁厂借着搬迁的机会也在进行着工艺改进。高炉炼铁导致的环境污染有________。
A.臭氧空洞 B.酸雨 C.一氧化碳毒害 D.沙尘暴
(4)写出高炉炼铁中与碳元素有关的氧化还原反应化学方程式:____________________________。
(5)从“三废”利用、环境保护等角度考虑,钢铁企业在生产中应采取的一些措施有(举出2种措施即可) _______________________________________。
Ⅰ.(1)烧杯、漏斗、玻璃棒
(2)2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32—
(3)2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
(4)CaO和CO2 Fe2O3和O2
Ⅱ.(1)石灰石 小 上部 (2)D (3)BC
(4)C+O2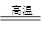 CO2;CO2+C
CO2;CO2+C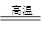 2CO;Fe2O3+3CO
2CO;Fe2O3+3CO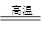 2Fe+3CO2
2Fe+3CO2
(5)用炼铁厂的炉渣(或CaSiO3)作为水泥厂的原料;用发电厂的煤矸石和粉煤灰作为水泥厂的原料;将石灰石煅烧成生石灰,用于吸收发电厂和焦化厂燃煤时产生的SO2,减少对空气的污染;建立污水处理系统(任选两条,其他合理答案也可以)
解析

下列有关资源的开发利用说法正确的是 ( )
| A.从海带中提取碘单质的过程一定涉及氧化还原反应 |
| B.从海水中可以得到NaCl,电解NaCl溶液可制备Na和Cl2 |
| C.天然气、乙醇和水煤气分别属于化石能源、不可再生能源和二次能源 |
| D.Cu、Al、Hg可以分别用热还原CuO、电解AlCl3和热分解HgO冶炼得到 |
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下: 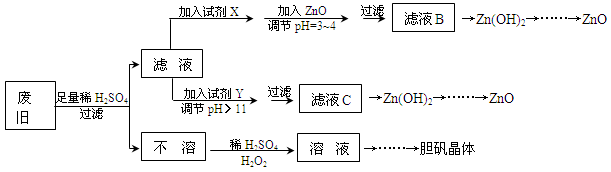
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| | Fe3+ | Fe2+ | Zn2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)试剂X可能是__________,其作用是____________________。
(2)加入ZnO调节pH=3~4的目的是____________________。
(3)由不溶物生成溶液D的化学方程式为______________________________。
(4)由溶液D制胆矾晶体包含的主要操作步骤是______________________________。
(5)下列试剂可作为Y试剂的是______。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________________。
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL。已知:上述滴定过程中的离子方程式如下:
2Cu2++4I-
 2CuI(白色)↓+I2,I2+2S2O32-
2CuI(白色)↓+I2,I2+2S2O32- 2I-+S4O62-
2I-+S4O62-①胆矾晶体的纯度为_______________。
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会__________(填“偏高”、“偏低”或“不变”)。
由菱镁矿(主要成分为MgCO3)制阻燃型氢氧化镁的工艺流程如下:
(1)从下面两图可以得出的结论为 、 。
图1 25℃时MgO水化随时间变化X射线衍射谱图 
图2 90℃时MgO水化随时间变化X射线衍射谱图
(2)水化反应MgO+H2O = Mg(OH)2能自发进行的原因是 。
(3)结合元素周期律和表1可知,金属氢氧化物受热分解的规律有 。(写一条即可)
表1 部分主族元素的金属氢氧化物热分解温度/℃
| LiOH | NaOH | KOH | Al(OH)3 | Mg(OH)2 | Ca(OH)2 | Ba(OH)2 |
| 924 | 不分解 | 不分解 | 140 | 258 | 390 | 700 |
(4)已知热化学方程式:Mg(OH)2 (s) =" MgO" (s)+H2O (g) ΔH =" 81.5" kJ·mol-1
①Mg(OH)2起阻燃作用的主要原因是 。
②与常用卤系(如四溴乙烷)和有机磷系(磷酸三苯酯)阻燃剂相比,Mg(OH)2阻燃剂的优点是 。
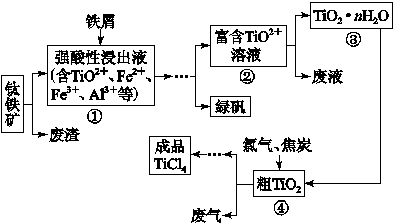
(14分)锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下:
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO):_______________________________________________。
(2)写出ZrOCl2·8H2O在900 ℃生成ZrO2的反应方程式: ______________ ______________________________________________。
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是________(单选)。
| A.二氧化锆纳米陶瓷是新型无机非金属材料 |
| B.1 nm=10-10m |
| C.锆合金的硬度比纯锆要高 |
| D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气 |
(4)一种新型燃料电池,一极通入空气,另一极通入丁烷;电解质是掺杂氧化钇(Y2O3)的二氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。在熔融电解质中,O2-向________(填“正”或“负”)极移动。电池正极电极反应为__________________,负极电极反应为________________________________。
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如下:
回答下列问题:
(1)在废渣溶解操作时,为了加速废渣溶解的措施是:___________________、__________________(任写两点)
(2)物质A是一种氧化剂
①工业上最好选用 (填序号)
| A.空气 | B.Cl2 | C.MnO2 | D.H2O2, |
③写出A参与反应的离子方程式为__________________________________________
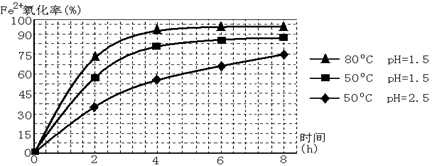
(3根据下图有关数据,你认为工业上氧化操作时应控制的条件是__________________。
(4)往铵黄铁矾溶液(含Fe3+)中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:_______________________________________________________。
(5)写出铵黄铁矾晶体溶于适量蒸馏水中,往其中加入过量Ba(OH)2溶液,发生反应的离子方程式为:_____________________________________________________
(6)回收所得的(NH4)2SO4晶体可能含有的杂质是:___________________________
下列有关生铁炼钢的叙述错误的是( )。
| A.添加必要的元素,改善钢材的组织结构和性能 |
| B.适当降低生铁中的含碳量,除去大部分硫、磷等杂质 |
| C.加入硅、锰、铝等合金元素调整成分并脱去钢水中的氧 |
| D.除去生铁中的非金属元素 |
 Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。