题目内容
15.有A、B、C、D、E五种元素,A元素形成的-2价阴离子比氦的核外电子数多8个.B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质.C为原子核内有12个中子的二价金属,当2.4g C与足量盐酸反应时,生成标准状况下的H2 2.24L.D的原子M层上有7个电子,E最外层比次外层多3个电子.(1)A在周期表中的位置第二周期第ⅥA族
(2)A、E氢化物的稳定性比较H2O>NH3.(填化学式)
(3)A、B、C、D四种元素的简单离子的半径由大到小的顺序Cl->O2->Na+>Mg2+(用离子符号表示)
(4)在一种含有A元素的有18个电子的化合物和稀盐酸的混合物中加入铜片,溶液变为蓝色,写出该反应的离子反应方程式Cu+H2O2+2H+=Cu2++2H2O.该化合物的电子式为
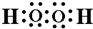 含有的化学键类型有BC(填序号).
含有的化学键类型有BC(填序号).A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(5)用电子式表示由C和D所组成的化合物的形成过程
 .
.
分析 有A、B、C、D、E五种元素,A元素形成的-2价阴离子比氦的核外电子数多8个,则A的质子数为2+8-2=8,则A为氧元素;B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,则B为Na元素,淡黄色固体为Na2O2;C为原子核内有12个中子的二价金属,当2.4gC与足量热水反应时,在标准状态下放出氢气2.24L,令C的相对原子质量为x,根据电子转移守恒,则$\frac{2.4g}{xg/mol}$×2=$\frac{2.24L}{22.4L/mol}$×2,解得x=24,故C的质子数为24-12=12,则C为Mg元素;D的M层上有7个电子,则D为Cl元素;E最外层比次外层多3个电子,原子只能有2个电子层,最外层电子数为5,故E为N元素,据此解答.
解答 解:有A、B、C、D、E五种元素,A元素形成的-2价阴离子比氦的核外电子数多8个,则A的质子数为2+8-2=8,则A为氧元素;B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,则B为Na元素,淡黄色固体为Na2O2;C为原子核内有12个中子的二价金属,当2.4gC与足量热水反应时,在标准状态下放出氢气2.24L,令C的相对原子质量为x,根据电子转移守恒,则$\frac{2.4g}{xg/mol}$×2=$\frac{2.24L}{22.4L/mol}$×2,解得x=24,故C的质子数为24-12=12,则C为Mg元素;D的M层上有7个电子,则D为Cl元素;E最外层比次外层多3个电子,原子只能有2个电子层,最外层电子数为5,故E为N元素.
(1)A为O元素,位于周期表中第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)A、E氢化物分别为H2O、NH3,由于非金属性O>N,故稳定性:H2O>NH3,故答案为:H2O>NH3;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:Cl->O2->Na+>Mg2+,故答案为:Cl->O2->Na+>Mg2+;
(4)一种含有A元素的有18个电子的化合物为H2O2,和稀盐酸的混合物中加入铜片,溶液变为蓝色,该反应的离子反应方程式:Cu+H2O2+2H+=Cu2++2H2O,化合物H2O2的电子式为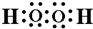 ,O原子之间形成非极性键,氧原子与H原子之间形成极性键,
,O原子之间形成非极性键,氧原子与H原子之间形成极性键,
故答案为:Cu+H2O2+2H+=Cu2++2H2O;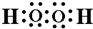 ;BC;
;BC;
(5)由C和D所组成的化合物为MgCl2,用电子式表示形成过程为: ,
,
故答案为: .
.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,是对学生综合能力的考查,注意理解掌握用电子式表示物质或化学键的形成.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH4原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似.
| A. | ①②③④ | B. | 只有②③ | C. | 只有③④ | D. | 只有①②③ |
( )
| A. | v(D)=0.40mol•L-1•s-1 | B. | v(C)=0.50mol•L-1•s_1 | ||
| C. | v(A)=0.30mol•L-1•s-1 | D. | v(B)=0.60mol•L-1•s-1 |
| A. | 2种 | B. | 1种 | C. | 4种 | D. | 5种 |
| A. | 1.7g OH- 所含电子数为0.9NA | |
| B. | 标准状况下,11.2 L HCl 所含质子数为18NA | |
| C. | 7.8gNa2O2固体中含有的离子数为4NA | |
| D. | 0.5 mol D2O 中所含质子数为5NA |
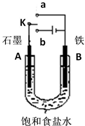
| A. | 若开始时开关K与a连接,其反应与铁的吸氧腐蚀类似 | |
| B. | 若开始时开关K与b连接,其原理类似于钢铁防护中外加电流的阴极保护法 | |
| C. | 若开始时开关K与b连接,则标准状况下B极产生2.24 L气体,转移电子0.2 mol | |
| D. | 若开始时开关K与b连接,则反应一段时间后加适量盐酸可恢复到电解前电解质相同的状态(质量和浓度均相同) |
| A. | 惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L | |
| B. | 标准状况下,4.0 g CH4中含有共价键的数目为NA | |
| C. | 1 mol C12发生化学反应,转移的电子数必为2NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
| A. | 分子式为C7H8O,且属于芳香族化合物的同分异构体只有4种 | |
| B. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物最多有6种 | |
| C. | 丙烷的一氯代物有2种,丙烷的二氯代物有4种 | |
| D. | 联苯(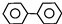 )的一氯代物有3种,二氯代物有12种 )的一氯代物有3种,二氯代物有12种 |
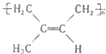 :其1mol单体跟1molBr2发生加成反应生成的产物有3种;
:其1mol单体跟1molBr2发生加成反应生成的产物有3种; .
.