题目内容
(12分)下图是某工厂生产甲醇(CH3OH)的工艺流程图:
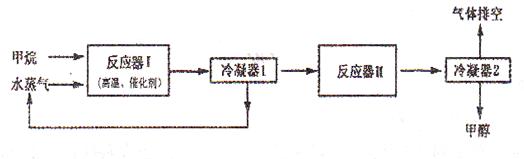
已知,在反应器II中CO在高温、高压、催化剂存在的条件下跟H2充分反应后,仍剩余1/3。请回答下列问题:
(1)在反应器I中,发生反应的化学方程式是_______________________ _____________。
_____________。
(2)从提高原子的利用率出发,该生产工艺需要进行的改进是_____________________。
(3)右图表示CO和H2反应合成甲醇过程中的能量变化,曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂时反应的能量变化。则
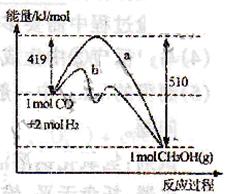
①反应的热化学方程式为___________________________________________。
②在恒容条件下,能使该反应的平衡常数改变的措施有_________________。(填字母)

已知,在反应器II中CO在高温、高压、催化剂存在的条件下跟H2充分反应后,仍剩余1/3。请回答下列问题:
(1)在反应器I中,发生反应的化学方程式是_______________________
 _____________。
_____________。(2)从提高原子的利用率出发,该生产工艺需要进行的改进是_____________________。
(3)右图表示CO和H2反应合成甲醇过程中的能量变化,曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂时反应的能量变化。则

①反应的热化学方程式为___________________________________________。
②在恒容条件下,能使该反应的平衡常数改变的措施有_________________。(填字母)
| A.加压 |
| B.降低温度 |
| C.再充入1mol CO和2molH2 |
| D.使用更高效的催化剂。 |
(12分)(1)CH4 + H2O(g) =" " CO + 3H2(3分)
(2)由冷凝器2排出的气体再导入反应器Ⅱ中进行循环利用(3分)
(3)①CO(g) + 2H2(g) ═ CH3OH(g) △H = -91 kJ·mol-1(3分) ②B(3分)
(2)由冷凝器2排出的气体再导入反应器Ⅱ中进行循环利用(3分)
(3)①CO(g) + 2H2(g) ═ CH3OH(g) △H = -91 kJ·mol-1(3分) ②B(3分)
略

练习册系列答案
相关题目
 SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为 H2SO4(浓)+ NaOH(aq)=
H2SO4(浓)+ NaOH(aq)=