题目内容
【题目】NO2、NO、CO、NO2-等是常见大气污染物和水污染物,研究NO2、NO、CO、NO2-等的处理对建设美丽中国具有重要意义。
已知:①NO2+CO![]() CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②![]() N2(g)+
N2(g)+ ![]() O2(g)
O2(g)![]() NO(g) △H=+89.75kJ/mol,K2
NO(g) △H=+89.75kJ/mol,K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol,K3
2NO2(g) △H=-112.3kJ/mol,K3
写出NO与CO反应生成无污染气体的热化学方程式:_____________,此热化学方程式的平衡常数K=_______(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=_______。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________。
,则反应开始到平衡时CO的平均反应速率v(CO)=_______。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________。
(3)研究发现:NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-1810kJ/mol
①相同条件下,在2L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化的情况如图所示。
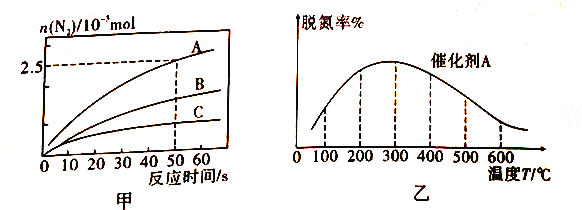
a.在催化剂A作用下,反应达到平衡的标志是_____(填序号)。
A.4v(NH3)正=6v(H2O)逆
B.容器内总压强不再改变
C.容器内密度不再改变
D.NO 和H2O(g)浓度相等
E.容器内平均摩尔质量不再改变
b.在A、B,C 三种催化剂下,清除氮氧化物反应的活化能分别表示为Ea(A)、Ea(B)、Ea(C),根据图甲所示曲线,判断三种催化剂条件下,活化能由大到小的顺序为________。
②在氨气足量时,反应在催化剂A 作用下,经过相同时间,测得脱氮潮殖反应温度的变化情况如图乙所示,据图可知,自相同的时间内,温度对脱氮率的影响及可他的原因是________。(已知A、B催化剂在此温度范围内不失效)。
【答案】 2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=759.8kJ/mol ![]() 0.008mol·L1·s1 0≤a<0.8 BE Ea(C)>Ea (B)>Ea (A) 300℃之前,反应未达平衡,反应正向进行,脱氮率随温度的升高而升高;300℃后,反应达到平衡,升温,平衡逆向移动,脱氮率减小
0.008mol·L1·s1 0≤a<0.8 BE Ea(C)>Ea (B)>Ea (A) 300℃之前,反应未达平衡,反应正向进行,脱氮率随温度的升高而升高;300℃后,反应达到平衡,升温,平衡逆向移动,脱氮率减小
【解析】(1)由已知,反应①的△H=(812+1076-1490-632)kJ/mol=-234kJ/mol,根据盖斯定律,由反应①×2+③-②×2可得:2NO2(g)+2CO(g) ![]() N2(g)+2CO2(g) △H=[-234×2+(-112.3)-179.5]kJ/mol=-759.8kJ/mol;当总反应式相加时平衡常数相乘,相减时平衡常数相除,成倍时平衡常数为幂,所以平衡常数K=
N2(g)+2CO2(g) △H=[-234×2+(-112.3)-179.5]kJ/mol=-759.8kJ/mol;当总反应式相加时平衡常数相乘,相减时平衡常数相除,成倍时平衡常数为幂,所以平衡常数K= ![]() ;(2)5s内反应消耗0.04mol CO,所以
;(2)5s内反应消耗0.04mol CO,所以![]() ,平衡常数
,平衡常数![]() ,a<0.8,所以,0≤a<0.8;(3)①a.A、4v(NH3)正=6v(H2O)逆,正逆反应速率之比不等于化学计量数之比,反应未达平衡状态,选项A错误;B.该反应为气体体积可变的反应,当容器内总压强不再改变,说明反应已达平衡状态,选项B正确;C.反应在恒容容器中进行且气体总质量不变,反应过程密度始终保持不变,容器内密度不再改变不能说明反应达平衡状态,选项C错误;D.NO 和H2O(g)浓度相等是一种特殊情况,反应不一定达平衡状态,选项D错误;E. 该反应为气体体积可变的反应,气体总质量不变,当容器内总物质的量不再改变,容器内平均摩尔质量不再改变,则反应达平衡状态,选项E正确。答案选BE;b.反应活化能越小,反应速率越快,由图可以看出v(A)>v(B)>v(C),Ea(C)>Ea (B)>Ea (A);②300℃之前,反应未达平衡,脱氮率随温度的升高而升高;300℃后,反应达到平衡,升温,脱氮率减小,说明正反应放热,所以,升温平衡逆向移动,脱氮率减小。
,a<0.8,所以,0≤a<0.8;(3)①a.A、4v(NH3)正=6v(H2O)逆,正逆反应速率之比不等于化学计量数之比,反应未达平衡状态,选项A错误;B.该反应为气体体积可变的反应,当容器内总压强不再改变,说明反应已达平衡状态,选项B正确;C.反应在恒容容器中进行且气体总质量不变,反应过程密度始终保持不变,容器内密度不再改变不能说明反应达平衡状态,选项C错误;D.NO 和H2O(g)浓度相等是一种特殊情况,反应不一定达平衡状态,选项D错误;E. 该反应为气体体积可变的反应,气体总质量不变,当容器内总物质的量不再改变,容器内平均摩尔质量不再改变,则反应达平衡状态,选项E正确。答案选BE;b.反应活化能越小,反应速率越快,由图可以看出v(A)>v(B)>v(C),Ea(C)>Ea (B)>Ea (A);②300℃之前,反应未达平衡,脱氮率随温度的升高而升高;300℃后,反应达到平衡,升温,脱氮率减小,说明正反应放热,所以,升温平衡逆向移动,脱氮率减小。