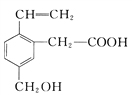
��Ŀ����
����Ŀ��ͭ����������ʹ�õĽ���֮һ���й�ʹ��ͭ����ʷ�����Զ����Լ��������ǧ����ǰ�й��˵����Ⱦͷ��ֲ���ʼʹ��ͭ����ͭ�������Ľ��������Ϻ�ɫ����չ�Ժã������Ժ͵����Ըߣ�����ڵ��º͵���������Ԫ������õIJ��ϣ���ش��������⣺
(1)��CuSO4��ҺΪ�������Һ���д�ͭ(��Al��Zn��Ag��Pt��Au������)�ĵ�⾫��������˵����ȷ����_______(��ѡ����ĸ)
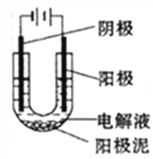
a.��ͭ�ӵ�Դ����,����������Ӧ
b.��Һ��Cu2+�������ƶ�
c.�������У������������������仯���
d.����������ɻ���Al��Zn�Ƚ���
(2)Ŀǰ�ĵ�·�壬��Ҫ����·��ͼ����ɣ���·����Ϊԭ��֮�䵼ͨ�Ĺ��ߣ�������ϻ�������ƴ�ͭ����Ϊ�ӵؼ���Դ�㣬��ӡˢ��·ʱ�����Ȼ�����Һ��Ϊ����ʴҺ���������ķ�ӦΪ______________��
(3) Cu�����ã�ͨ������²���ϡ���ᷴӦ������Cu��ϡ����Ļ�����е���H2O2��Һ����Һ�ܿ����ɫ����д���÷�Ӧ�����ӷ���ʽ___________________��
(4)Cu2O�е�Cu+���ȶ�����Cu2O�μ�ϡ���ᣬ���Ϻ�ɫ�������ɣ���Һ��Ϊ��ɫ��д����Ӧ�����ӷ���ʽ_________________��
(5)����ͭ��ԭ����Cu2+O2![]() 2Cu+SO2���ڸķ�Ӧ��ÿ����1molCu��ת��________mole-��
2Cu+SO2���ڸķ�Ӧ��ÿ����1molCu��ת��________mole-��
���𰸡�abCu2++2e- = Cu(2) 2FeCl3��Cu��2FeCl2��CuCl2Cu+H2O2+2H+=Cu2++2H2OCu2O+ 2H+ = Cu2++ Cu +H2O3
��������
��������⾫��ͭʱ����ͭ���������õ缫��Zn��Fe��Ni��Cuʧ���ӣ���ͭ���������ü�����ͭ���ӵõ��ӣ�������ͭ�Լ���ͭ���õĽ������ܽ⣬��û��ͭ���õĽ���������������£��γ������ࣻ(2)�Ȼ�����Һ�ܰ�ͭ����Ϊͭ���ӣ�(3)����������ͭ��������������Ϊͭ���ӣ�(4) Cu+���ȶ�����Cu2O�μ�ϡ���ᣬ���Ϻ�ɫCu���ɣ���Һ��Ϊ��ɫ˵����Cu2+���ɣ�(5)Cu2S �ڷ�Ӧ�У�ͭԪ�ػ��ϼ۴�+1�۱仯����Ϊ0�ۣ���Ԫ�ػ��ϼ۴�-2�����ߵ�+4�ۡ�
�����⾫��ͭʱ����ͭ���������ӵ�Դ����������������Ӧ����a��ȷ����Һ��Cu2+�������ƶ����������Ϸ�����ԭ��Ӧ����b��ȷ���������У�����Zn��Fe��Ni��Cuʧ����������ֻ��Cu2+�������ƶ����������Ϸ�����ԭ��Ӧ����ͭ�����������仯����ȣ���c�����������ϣ���ͭ���õ�Al��Znʧ���ӱ�Ϊ�����ӣ�������û��Al��Zn�Ƚ�������d����(2)�Ȼ�����ͭ��Ӧ�����Ȼ��������Ȼ�ͭ������ʽΪ2FeCl3��Cu��2FeCl2��CuCl2 ��(3)����������ͭ��������������Ϊͭ���ӣ���Ӧ���ӷ���ʽΪCu+H2O2+2H+=Cu2++2H2O ��(4)Cu2O�е�Cu+���ȶ�����Cu2O�μ�ϡ���ᣬ���Ϻ�ɫ�������ɣ���Һ��Ϊ��ɫ����Ӧ�����ӷ���ʽCu2O+ 2H+ = Cu2++ Cu +H2O ��(5) Cu2S �ڷ�Ӧ�У�ͭԪ�ػ��ϼ۴�+1�۱仯����Ϊ0�ۣ���Ԫ�ػ��ϼ۴�-2�����ߵ�+4�ۣ�����1molCu��ת��3 mole-��

����Ŀ����¯������ұ��������Ҫ��������������Ҫ��ӦΪ��
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ��H
2Fe(s)+3CO2(g) ��H
��Ӧ1�� Fe2O3(s)+3C(ʯī��s) ![]() 2Fe(s)+3CO(g) ��H1
2Fe(s)+3CO(g) ��H1
��Ӧ2�� C(ʯī��s)+CO2(g)![]() 2CO(g) ��H2
2CO(g) ��H2
�١�H= _________(�ú���H1�� ��H2����ʽ��ʾ��
�ڱ����¶Ȳ��䣬�ں��������н��з�Ӧ1���ﵽƽ��״̬���ٴγ���һ������CO (Fe����������ƽ��_________�ƶ�(������������ﵽ��ƽ���c(CO)��_________(��������С�����䡱)
(2)��T��ʱ����Ӧ Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)��ƽ�ⳣ��K=64,��2L�����ܱ����������У��ֱ��±���ʾ�������ʣ���Ӧ����һ��ʱ���ﵽƽ�⡣
2Fe(s)+3CO2(g)��ƽ�ⳣ��K=64,��2L�����ܱ����������У��ֱ��±���ʾ�������ʣ���Ӧ����һ��ʱ���ﵽƽ�⡣
Fe2O3 | CO | Fe | CO2 | |
��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
��/mol | 1.0 | 1.5 | 1.0 | 1.0 |
�ټ�������CO��ƽ��ת����Ϊ_________
������˵����ȷ����_________������ĸ����
A��������ѹǿ�㶨��˵����Ӧ�ﵽƽ��״̬
B������Fe2O3���������CO��ת����
C����������CO��ƽ��ת���ʴ����ҵ�ƽ��ת����
D���������й����������ٸı䣬˵����Ӧ�ﵽƽ��״̬
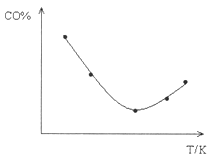
��ȡ��ȷ�CO���ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У���װ������Fe2O3������Ӧ��ͬʱ��ֱ�ⶨ��ϵ��CO�����������CO%�������������淴Ӧ�¶ȣ�T���仯�Ĺ�ϵͼ�����ڴ��������ƽ��ʱ��������ƽ����Է��������淴Ӧ�¶ȣ�T���ı仯ʾ��ͼ��
_________