题目内容
【题目】根据下列热化学方程式
① C(s)+O2(g)═CO2 (g)△H1=﹣393.5kJ/mol
② H2(g)+ ![]() O2(g)═H2O(l)△H2=﹣285.8kJ/mol
O2(g)═H2O(l)△H2=﹣285.8kJ/mol
③ CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=﹣870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
A.△H=﹣488.3 kJ/mol
B.△H=+244.1 kJ/mol
C.△H=﹣996.6 kJ/mol
D.△H=+996.6 kJ/mol
【答案】A
【解析】解:①C(s)+O2(g)═CO2 (g)△H1=﹣393.5kJ/mol
② H2(g)+ ![]() O2(g)═H2O(l)△H2=﹣285.8kJ/mol ③ CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=﹣870.3kJ/mol
O2(g)═H2O(l)△H2=﹣285.8kJ/mol ③ CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=﹣870.3kJ/mol
依据盖斯定律①×2﹣③+②×2得到
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=﹣488.3 kJ/mol
故选A.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】下列分离提纯的方法不正确的是( )
选项 | 混合物 | 分离、提纯方法 |
A. | 分离苯和水 | 分液法 |
B. | 分离乙醇和甲醇 | 蒸馏法 |
C. | 除去乙炔中H2S气体 | 用CuSO4溶液洗气 |
D. | 除去水中的少量苯酚 | 过滤 |
A.A
B.B
C.C
D.D
【题目】将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
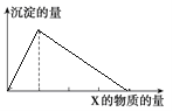
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A. A B. B C. C D. D
