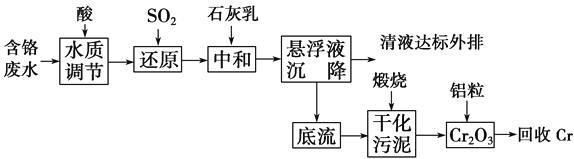
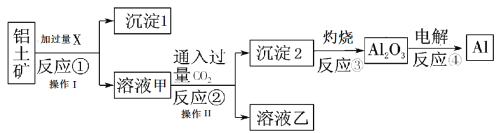
题目内容
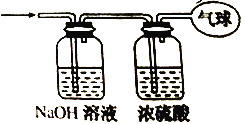
【题目】(1)按如图所示操作,充分反应后:
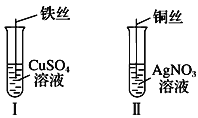
①Ⅰ中发生反应的离子方程式为______________;
②Ⅱ中铜丝上观察到的现象是_____________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为________。
(2)黑火药爆炸时发生反应:2KNO3+S+3C=K2S+N2↑+3CO2↑,其中被还原的元素是__,被氧化的元素是____,氧化剂是____,还原剂是__,氧化产物是____,还原产物是_____。
(3)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中氧化产物是_____;若反应中转移了0.3 mol电子,则还原产物的质量是____g。
【答案】Fe+Cu2+=Fe2++Cu 红色铜丝上有银白色金属附着 Ag+>Cu2+>Fe2+ N、S C KNO3、S C CO2 N2、K2S S 3
【解析】
(1)①发生Fe与硫酸铜的置换反应生成Cu和硫酸亚铁,离子反应为Fe+Cu2+=Fe2++Cu,
故答案为:Fe+Cu2+=Fe2++Cu;
②发生Cu与硝酸银的置换反应,该反应为Cu+2AgNO3═Cu (NO3)2+2Ag,观察到红色铜丝上有白色金属Ag附着,
故答案为:红色铜丝上有白色金属Ag附着;
③由两个反应可知,得到电子的为氧化剂,还有剂对应的产物为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,由Fe+Cu2+=Fe2++Cu可知,氧化性Cu2+>Fe2+;Cu+2AgNO3═Cu(NO3)2+2Ag可知,氧化性Ag+>Cu2+,则氧化性为Ag+>Cu2+>Fe2+,
故答案为:Ag+>Cu2+>Fe2+;
(2)黑火药爆炸时发生反应:2KNO3+S+3C=K2S+N2↑+3CO2↑,该反应中S元素化合价由0价变为2价、N元素化合价由+5价变为0价、C元素化合价由0价变为+4价,其中被还原的元素是N、S,被氧化的元素是C,氧化剂是KNO3、S,还原剂是C,氧化产物是CO2,还原产物是N2、K2S;
故答案为:N、S;C;KNO3,S;C;CO2;N2、K2S;
(3)HNO3有强氧化性,H2S具有较强还原性,二者反应氧化还原反应,故NO为还原产物、S为氧化产物,若反应过程中转移了0.3mol电子,由电子转移守恒,可知生成NO的物质的量为:![]() =0.1mol,故生成S的质量为:0.1mol×30g/mol=3g,
=0.1mol,故生成S的质量为:0.1mol×30g/mol=3g,
故答案为:S;3。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案【题目】化学在能源开发与利用中起着十分关键的作用。能源分为一级能源和二级能源,将自然界中存在的能源称为一级能源,通过其它方式获得的能源称为二级能源。甲烷、氢气是重要的能源。回答下列问题:
(1)关于甲烷、氢气的说法正确的是___
A.甲烷和氢气都是一级能源 B.甲烷是一级能源,氢气是二级能源
C.甲烷和氢气都是二级能源 D.甲烷是二级能源,氢气是一级能源
(2)![]() 经催化重整可以获得合成气:
经催化重整可以获得合成气:![]()
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H |
| H—H |
|
键能/ | 413 | 745 | 436 | 1075 |
则该反应的![]() _____
_____![]() 。
。
②已知:![]()
![]()
![]()
![]()
而C(s)的燃烧热![]()
该催化重整反应的![]() ___
___![]() (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。
(3)氢气是氯碱工业的副产品,产生氢气的电极反应式为___。
(4)利用氢气可以合成氨,将![]() 通入NaClO的溶液中可以获得
通入NaClO的溶液中可以获得![]() 写出
写出![]() 的电子式__。该反应的化学方程式为____。
的电子式__。该反应的化学方程式为____。
(5)CO也是一种重要燃料,利用其燃烧可以设计成新型燃料电池,该电池利用熔融的碳酸盐为电解质,该燃料电池负极的电极反应式为____。