题目内容
18.下列说法正确的是( )| A. | 以铜作阴极、铁作阳极、硫酸铜为电解液可完成铁上镀铜 | |
| B. | 水的电离是吸热过程,升高温度,水的离子积增大、pH减小 | |
| C. | 由反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO,可得出C的非金属性强于Si | |
| D. | pH=9的醋酸钠溶液和pH=9的氨水中水的电离程度相同 |
分析 A、电镀时,镀件作阴极,镀层金属是阳极,电镀液中必须含有镀层金属阳离子的盐;
B、水的电离过程是吸热过程,升高温度,平衡向右移动;
C、元素的非金属性是指元素的原子得电子的能力,得电子能力越强对应单质的氧化性越强;
D、含有弱根离子的盐能促进水的电离,酸或碱能抑制水的电离,据此解答即可.
解答 解:A、电镀时,镀件作阴极,镀层金属是阳极,电镀液中必须含有镀层金属阳离子的盐,即铁为阴极、铜片为阳极、硫酸铜为电镀液可以实现铁制品镀铜,故A错误;
B、水的电离过程是吸热过程,升高温度,平衡向右移动,水的离子积增大,氢离子浓度增大,所以pH减小,故B正确;
C、该反应中C是还原剂,Si是还原产物,主要体现碳的还原性,故C错误;
D、pH=9的醋酸钠溶液氢氧根离子来源于水的电离,即水电离出的氢氧根离子浓度为$\frac{1{0}^{-14}}{1{0}^{-9}}$=10-5,pH=9的氨水氢离子来源于水的电离,即水电离出的氢离子浓度为10-9,故两者不相同,故D错误;
故选B.
点评 本题主要考查的是水的电离以及水的电离影响因素,含有弱根的盐促进水的电离,酸和碱均能抑制水的电离,据此解答即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.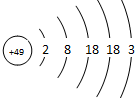 张青莲是我国著名的化学家.1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中的首次采用我国测定的原子量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中的首次采用我国测定的原子量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
 张青莲是我国著名的化学家.1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中的首次采用我国测定的原子量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中的首次采用我国测定的原子量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )| A. | In在反应中容易失电子 | |
| B. | In为长周期元素 | |
| C. | In的最高价氧化物对应的水化物为强碱 | |
| D. | In为过渡元素 |
9.关于如图所示的氢氧燃料电池的说法错误的是( )


| A. | 电极a是负极 | |
| B. | 电极b上的电极反应为O2+2H2O+4e-=4OH- | |
| C. | 外电路中电子由电极b流向电极a | |
| D. | 氢氧燃料电池的优点是高效、对环境友好 |
6.关于 的下列说法中正确的是( )
的下列说法中正确的是( )
 的下列说法中正确的是( )
的下列说法中正确的是( )| A. | 分子式为C9H9O2 | |
| B. | 含有三种官能团 | |
| C. | 可使溴的四氯化碳溶液或酸性KMnO4溶液褪色 | |
| D. | 可以发生取代反应和加成反应,但不能发生聚合反应 |
13.海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-.
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
盐卤$\stackrel{Cl_{2}}{→}$低浓度Br2$\stackrel{Na_{2}CO_{3}}{→}$溶液Ⅰ$\stackrel{H_{2}SO_{4}}{→}$Br2
将Br2与Na2CO3反应的化学方程式补充完整:□Br2+□Na2CO3═NaBrO3+□5NaBr+□3CO2↑
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
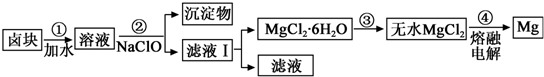
生成氢氧化物沉淀的pH
①步骤②中需控制pH=9.8,其目的是除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去.
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+.
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因Mg2++2H2O Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClO22.35g.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-.
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
盐卤$\stackrel{Cl_{2}}{→}$低浓度Br2$\stackrel{Na_{2}CO_{3}}{→}$溶液Ⅰ$\stackrel{H_{2}SO_{4}}{→}$Br2
将Br2与Na2CO3反应的化学方程式补充完整:□Br2+□Na2CO3═NaBrO3+□5NaBr+□3CO2↑
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+.
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因Mg2++2H2O
 Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClO22.35g.
3.依据下列说法来判断相应元素的金属性、非金属性强弱,不合理的是( )
| A. | 卤素单质Cl2、Br2、I2的氧化性 | |
| B. | 气态氢化物NH3、H2O、HF的稳定性 | |
| C. | 碱金属单质Li、Na、K与水反应的剧烈程度 | |
| D. | 1mol Na、Mg、Al分别与足量盐酸反应时失电子数的多少 |
10.下列各组元素性质或原子结构的递变,叙述不正确的是( )
| A. | Na、Mg、Al原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增大 | |
| C. | Li、Na、K的电子层数依次增多 | |
| D. | N、O、F得电子能力依次减弱 |
7.已知金属单质X、Y、Z、W之间有下列关系
①2X+3Y2+=2X3++3Y;
②Z元素最高价氧化物对应的氢氧化物的碱性比X元素的强;
③由Y、W与稀硫酸组成的原电池,Y为负极.
则X、Y、Z、W的还原性由强到弱的顺序为( )
①2X+3Y2+=2X3++3Y;
②Z元素最高价氧化物对应的氢氧化物的碱性比X元素的强;
③由Y、W与稀硫酸组成的原电池,Y为负极.
则X、Y、Z、W的还原性由强到弱的顺序为( )
| A. | X>Z>Y>W | B. | Z>W>X>Y | C. | Z>Y>X>W | D. | Z>X>Y>W |
8.短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中Q元素的原子的K、M层的电子数之和等于L层的电子数,则下列说法正确的是( )
| Y | W | ||
| X | Z | Q |
| A. | X的氧化物是红宝石、蓝宝石的主要成分 | |
| B. | Q的最高价氧化物的水化物的浓溶液中只存在一种分子 | |
| C. | W的氧化物有多种,其中只有+2价的氧化物有毒,对人体有危害 | |
| D. | Z的单质可由Z的氧化物与Y的单质反应制得,说明单质Y还原性强于单质Z |