题目内容
5.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 非标准状况下,1mol任何气体的体积不可能为22.4L | |
| B. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| C. | 25℃,1.01×105Pa,16gCH4中含有的原子数为5NA | |
| D. | 92g NO2和N2O4的混合物含有的分子数为2NA |
分析 A、在非标况下,气体摩尔体积也可能是22.4L/mol;
B、标况下水为液态;
C、求出甲烷的物质的量,然后根据1mol甲烷中含5mol原子来分析;
D、NO2和N2O4的摩尔质量分别为46g/mol和92g/mol.
解答 解:A、在非标况下,气体摩尔体积也可能是22.4L/mol,故1mol气体的体积也可能为22.4L,故A错误;
B、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、16g甲烷的物质的量为1mol,而1mol甲烷中含5mol原子,即5NA个,故C正确;
D、NO2和N2O4的摩尔质量分别为46g/mol和92g/mol,若92g全部为NO2,则分子个数为2NA个;若全部为四氧化二氮,则分子个数为NA个,现在为两者的混合物,故分子数介于NA到2NA之间,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
20.下列说法中正确的是( )
| A. | 由C(s金刚石)=C(s石墨)△H=-1.19kJ/mol可知石墨比金刚石稳定 | |
| B. | 等质量的硫固体和硫蒸气分别完全燃烧,前者放出的热量多 | |
| C. | 热化学方程式中的化学计量数可以表示反映物质和生成物的微粒个数 | |
| D. | 2g H2完全燃烧生成液态水是将放出285.8kJ的热,则此反应的热化学方程式为2H2O(l)=2H2(g)+O2(l)△H=-285.8KJ/mol |
13.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5的酸碱性为酸性,试样的pH=4.
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.30kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3 c.CaCl2d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0,若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是该反应是吸热反应,温度升高,反应速率加快,平衡向正方向移动,单位时间内产生的NO多.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)
已知该反应的△H>0,简述该设想能否实现的依据:不能实现,因为该反应的△H>0,△S<0,所以△H-T△S>0,在任何温度下均不能自发进行.
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2N0$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.30kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3 c.CaCl2d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0,若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是该反应是吸热反应,温度升高,反应速率加快,平衡向正方向移动,单位时间内产生的NO多.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)
已知该反应的△H>0,简述该设想能否实现的依据:不能实现,因为该反应的△H>0,△S<0,所以△H-T△S>0,在任何温度下均不能自发进行.
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2N0$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
10.某学生的实验报告所列出的下列数据中合理的是( )
| A. | 用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL | |
| B. | 用托盘天平称得25.20g NaCl | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 用10mL量筒量取7.13mL稀盐酸 |
17.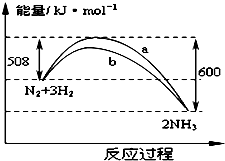 如图是425℃时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
如图是425℃时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
 如图是425℃时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
如图是425℃时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92kJ•mol-1 | |
| B. | 一定条件下N2+3H2═2NH3达到平衡时,3v正(H2)=2v逆(NH3) | |
| C. | 加入催化剂,该反应的反应热发生改变 | |
| D. | 温度、容器体积一定,通入1molN2和3molH2反应后放出的热量为Q1kJ,若通入2 molN2和6 molH2反应后放出的热量为Q2kJ,则有184>Q2>2Q1 |
15.2009年8月15日~12月15日,公安部在全国开展为期四个月的严厉整治酒后驾驶交通违法行为专项行动,在执法中,交警用装有重铬酸钾[K2Cr2O7]的仪器检测司机是否酒后开车,因为酒中的乙醇分子可以使橙红色的重铬酸钾变成绿色的硫酸铬[Cr2(SO4)3].下列有关重铬酸钾的说法中正确的是( )
| A. | 铬元素的化合价为+7价 | B. | 在检查时重铬酸钾发生氧化反应 | ||
| C. | 重铬酸钾具有强氧化性 | D. | 它由橙红色变为绿色是物理变化 |


 .
.