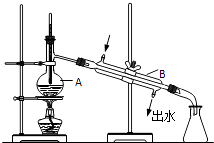
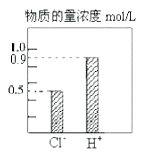
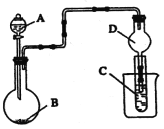
题目内容
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是( )

①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
根据上述反应,下列说法正确的是
A.右图表示反应①中的能量变化
B.可推知2H2(g)+O2(g)=2H2O(g) ΔH=-483.8 kJ/mol
C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D.CH3OH转变成H2的过程一定要吸收能量
【答案】B
【解析】
试题分析:A、图中反应物总能量高于生成物总能量,表示的是放热反应,而反应①是吸热反应,错误;B、依据盖斯定律②-①得到H2(g)+1/2O2(g)=H2O(g)△H=-241.9 kJ/mol;所以2H2(g)+O2(g)=2H2O(g)△H=-483.8 kJ/mol;正确;C、反应②甲醇反应生成二氧化碳和氢气的焓变-192.9kJ/mol;而1 mol CH3OH充分燃烧生成二氧化碳和水放出的热量大于192.9 kJ;错误;D、CH3OH转变成H2的过程按照反应①是吸热反应,按照②反应是放热反应,所以不一定要吸收能量,错误;

 特高级教师点拨系列答案
特高级教师点拨系列答案【题目】根据所学知识填空。
(1)与标准状况下4.48L CO2中所含氧原子数目相同的水的质量是g;
(2)V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42﹣的物质的量浓度为mol/L;
(3)9.2g氮的氧化物(NOx)中含氮原子0.2mol,则x的数值为;
(4)0.4mol某气体的体积为9.8L,则该气体的摩尔体积为 , 气体所处的条件(填“是”或“不是”)标准状况.
(5)下列是常用的中和胃酸的药物:
药名 | 胃舒平 | 达喜 |
有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO34H2O |
相对分子质量 | 78 | 530 |
每片含有效成份的药量 | 0.245g | 0.5g |
估算10片胃舒平和5片达喜,含铝的物质的量较多的是 .