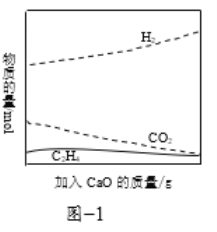
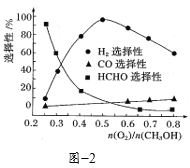
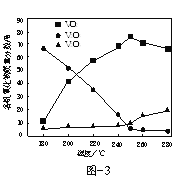
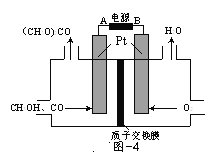
题目内容
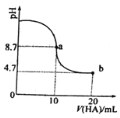
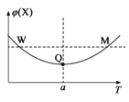
【题目】在某2 L恒容密团容器中充入2 mol X(g)和1mol Y(g)发生反应:2X(g)+ Y(g)![]() 3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示:下列推断正确的是( )
3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示:下列推断正确的是( )
A.升高温度,平衡常数增大
B.Q点时,Y的转化率最大
C.W点Y的正反应速率等于M点Y的正反应速率
D.平衡时充入Y,达到新平衡时Y的体积分数比原平衡时小
【答案】B
【解析】
温度在a℃之前,升高温度,X的含量减小,温度在a℃之后,升高温度,X的含量增大,曲线上最低点为平衡点,最低点之前未达平衡,是建立平衡的过程,最低点之后,各点为平衡点,升高温度X的含量增大,平衡向逆反应方向移动,故正反应为放热反应,据此分析解答。
A.根据上述分析,该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,故A错误;
B.曲线上最低点Q为平衡点,升高温度平衡向逆反应方向移动,Y的转化率减小,所以Q点时,Y的转化率最大,故B正确;
C.两点Y的浓度相同,W点对应的温度低于M点对应的温度,温度越高,反应速率越高,所以W点Y的正反应速率小于M点Y的正反应速率,故C错误;
D.平衡时充入Y,平衡正向移动,达到新平衡时,Y的转化率减小,Y的体积分数比原平衡时大,故D错误;
故选B。

练习册系列答案
相关题目