��Ŀ����
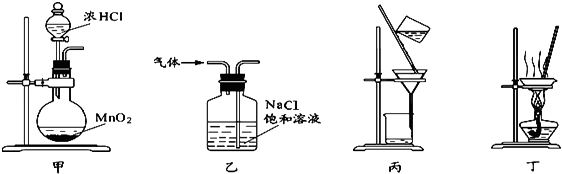
����Ŀ��ij��ѧ��ȤС����ʵ�������������ʵ��װ����ȡƯ�ۣ���ش��������⣺
��1����дʵ�����Ʊ�������ѧ���� ��
��2��ͼ���еμ�Ũ�����װ������ �� ��װ�õ������� ��
��3�����ú���0.4mol HCl��Ũ������������MnO2��Ӧ���������Ƶõ������������״���£�����С��2.24L ��ԭ���� ��
��4��Ư�۵���Ч�ɷֵ������� �� Ư���ڿ����г��ڷ���ʧЧ�Ļ�ѧ������ ��
��5������ȤС����100mL 12mol/L������8.7g MnO2�Ʊ��������������������������ʯ���鷴Ӧ���������������Ƶ�gƯ�ۣ�
���𰸡�
��1��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��2����Һ©��,��ȥCl2�л��е�HCl����
��3�����ŷ�Ӧ�Ľ��л�����ӷ�,����Ũ�ȱ�ϡ�����ٷ�Ӧ
��4��Ca��ClO��2,Ca��ClO��2+CO2+H2O=2HClO+CaCO3,2HClO ![]() 2HCl+02��
2HCl+02��
��5��12.7
���������⣺��1��ʵ������ȡ��������Ũ����Ͷ������̷���������ԭ��Ӧ�����Ȼ��̡�������ˮ����Ӧ�Ļ�ѧ����ʽΪ��
MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
��2���μ�Ũ�����װ������Ϊ��Һ©����Ũ����Ͷ������̷�Ӧ�����лᷢ���Ȼ������壬����ͨ������ʳ��ˮ�������dz�ȥCl2�л��е�HCl���壻
��3������MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O���ŷ�Ӧ�Ľ��л�����ӷ�������Ũ�ȱ�ϡ�����ٷ�Ӧ�����������й�ʣ�����Ƶõ������������״���£�����С��2.24L��
MnCl2+Cl2��+2H2O���ŷ�Ӧ�Ľ��л�����ӷ�������Ũ�ȱ�ϡ�����ٷ�Ӧ�����������й�ʣ�����Ƶõ������������״���£�����С��2.24L��
��4����ҵ��������ʯ�Һ�������Ӧ�����Ȼ��ơ�������ƺ�ˮ�ķ�Ӧ�Ʊ�Ư�ۣ���Ӧ�Ļ�ѧ����ʽΪ2Ca��OH��2+2Cl2=CaCl2+Ca��ClO��2+2H2O��
��������ܺ��ᷴӦ���ɴ����ᣬ���������Ư���ԣ�����Ư�۵���Ч�ɷ���Ca��ClO��2������������С��̼�ᣬ������ƺͶ�����̼��ˮ��Ӧ���ɴ����ᣬ������ȶ��������ֽ⣬����Ư��ʧЧ����Ӧ����ʽΪCa��ClO��2+CO2+H2O=2HClO+CaCO3��2HClO ![]() 2HCl+O2����
2HCl+O2����
��5��������Ũ������8.7g MnO2�Ʊ��������������������������ʯ���鷴Ӧ���������������Ƶ�Ca��ClO��2���������ݷ�ӦMnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��2Cl2+2Ca��OH��2�TCaCl2+Ca��ClO��2+2H2O���õ�������ϵ��8.7g MnO2���ʵ���Ϊ0.1mol��
MnCl2+Cl2��+2H2O��2Cl2+2Ca��OH��2�TCaCl2+Ca��ClO��2+2H2O���õ�������ϵ��8.7g MnO2���ʵ���Ϊ0.1mol��
2MnO2�� | CaCl2�� | Ca��ClO��2 |
2 | 1 | 1 |
0.1mol | 0.05mol | 0.05mol |
���������������Ƶ�Ca��ClO��2 ����=0.05mol��143g/mol=7.15g��CaCl2 ����=0.05mol��111g/mol=5.55g�����������������Ƶ�7.15+5.55=12.7gƯ�ۣ�
�ʴ�Ϊ����1��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O����2����Һ©������ȥCl2�л��е�HCl���壻��3�����ŷ�Ӧ�Ľ��л�����ӷ�������Ũ�ȱ�ϡ�����ٷ�Ӧ����4��Ca��ClO��2+CO2+H2O=2HClO+CaCO3��2HClO
MnCl2+Cl2��+2H2O����2����Һ©������ȥCl2�л��е�HCl���壻��3�����ŷ�Ӧ�Ľ��л�����ӷ�������Ũ�ȱ�ϡ�����ٷ�Ӧ����4��Ca��ClO��2+CO2+H2O=2HClO+CaCO3��2HClO ![]() 2HCl+O2������5��12.7
2HCl+O2������5��12.7
��1��ʵ������Ũ������MnO2������ȡ������
��2��Һ��ĵμ��÷�Һ©�������������ڱ���ʳ��ˮ��
��3��Ũ������лӷ��ԣ����ڷ�Ӧ�У�Ũ�������������Ժͻ�ԭ�ԣ�
��4��Ư�۵���Ҫ�ɷ���CaCl2��Ca(ClO)2����Ч�ɷ���Ca(ClO)2����¶���ڿ�������������е�CO2��Ӧ�����ʣ�
��5������ط�Ӧ�Ļ�ѧ����ʽ�ó���ϵʽ2MnO2~CaCl2~Ca(ClO)2���Ӷ��ó�Ca(ClO)2��CaCl2��������

 ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�����Ŀ����300mL���ܱ������У��������۲�����һ������CO���壬һ�������·�����Ӧ��Ni��s��+4CO��g��Ni��CO��4��g������֪�÷�Ӧƽ�ⳣ�����¶ȵĹ�ϵ�����
�¶�/�� | 25 | 80 | 230 |
ƽ�ⳣ�� | 5��104 | 2 | 1.9��10��5 |
����˵������ȷ���ǣ� ��
A.��������Ni��CO��4��g���ķ�ӦΪ���ȷ�Ӧ
B.25��ʱ��ӦNi��CO��4��g��Ni��s��+4CO��g����ƽ�ⳣ��Ϊ2��10��5
C.80��ﵽƽ��ʱ�����n��CO��=0.3mol����Ni��CO��4��ƽ��Ũ��Ϊ2 mol/L
D.��80��ʱ�����ijʱ�̣�Ni��CO��4��COŨ�Ⱦ�Ϊ0.5 mol/L�����ʱv��������v���棩