题目内容
1.用NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 4 g氦气中含有的分子数和原子数均为NA | |
| B. | 标准状况下,22.4 L CCl4中含有的分子数为NA | |
| C. | 1 L 0.1 mol•L-1乙醇溶液中含有的氧原子数为0.1NA | |
| D. | 1 mol Cl2完全反应转移的电子数一定是2NA |
分析 A、氦气为单原子分子;
B、标况下,四氯化碳为液态;
C、乙醇溶液中,除了乙醇中含氧原子,水中也含氧原子;
D、氯元素的价态有:+7、+5、+3、+1、0、-1价等.
解答 解:A、氦气为单原子分子,一个氦原子即一个氦分子,故4g氦气中含有的氦原子和氦分子个数均为N=$\frac{4g}{4g/mol}{N}_{A}$=NA,故A正确;
B、标况下,四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、乙醇溶液中,除了乙醇中含氧原子,水中也含氧原子,故此溶液中含有的氧原子的个数大于0.1NA个,故C错误;
D、氯元素的价态有:+7、+5、+3、+1、0、-1价等,由于不确定氯气反应后变为几价,故1mol氯气反应后转移的电子不能确定,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
12.在2NO2(g)?N2O4(g)的可逆反应中,下列状态属平衡状态的是( )
①υ正=υ逆≠0时的状态 ②NO2全部转变成N2O4的状态 ③C(NO2)=C(N2O4)的状态 ④N2O4不再分解的状态 ⑤混合物中,NO2的百分含量不再改变的状态 ⑥NO2的分子数与N2O4分子数的比值为2:1的状态 ⑦体系的颜色不再发生变化的状态.
①υ正=υ逆≠0时的状态 ②NO2全部转变成N2O4的状态 ③C(NO2)=C(N2O4)的状态 ④N2O4不再分解的状态 ⑤混合物中,NO2的百分含量不再改变的状态 ⑥NO2的分子数与N2O4分子数的比值为2:1的状态 ⑦体系的颜色不再发生变化的状态.
| A. | ①③④⑤⑥ | B. | ①⑤⑦ | C. | ②④⑤⑥ | D. | ①④⑤⑦ |
9.关于卤素(用X表示)的下列叙述中正确的是( )
| A. | 卤素单质与水反应的通式为X2+H2O?HX+HXO | |
| B. | HX都极易溶于水,它们的热稳定性随核电荷数增大而增强 | |
| C. | 卤素单质的颜色随相对分子质量增大的顺序而加深 | |
| D. | X-的还原性随卤素的核电荷数增大而增强,核电荷数小的卤素单质可将核电荷数大的卤素从它的盐溶液里置换出来 |
16.影响化学反应速率的因素很多,下列措施中能减慢化学反应速率的是( )
| A. | 用铁粉代替铁钉与稀盐酸反应 | |
| B. | 将食物由常温保存改为在冰箱中保存 | |
| C. | 加入MnO2粉末做H2O2分解反应的催化剂 | |
| D. | 用 3 mol/L 的盐酸代替 1 mol/L 的盐酸与锌粒反应 |
6.用98%的浓硫酸(密度为1.84g•cm-3)配制1mol•L-1的稀硫酸100mL.配制过程中可能用到下列仪器:①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒.按使用先后顺序排列正确的是( )
| A. | ④③⑦⑤⑥ | B. | ②⑤⑦④⑥ | C. | ④③⑤⑥⑦ | D. | ②⑥③⑦⑤⑥ |
13.在一定条件下,16g A恰好能跟20g B完全反应,生成C和4.5g D;若在相同条件下,将8g A和15g B反应时,则生成D和0.125mol的C,则物质C的摩尔质量是( )
| A. | 252 g•mol-1 | B. | 168 g•mol-1 | C. | 126 g•mol-1 | D. | 36 g•mol-1 |
10.下列物质属于电解质的是( )
| A. | 酒精 | B. | 食盐水 | C. | 二氧化硫 | D. | 氯化钡 |
11.下列物质与铁反应后的生成物,能与KSCN溶液作用生成红色溶液的是( )
| A. | 氯气 | B. | 盐酸 | C. | 硫酸铜溶液 | D. | 稀硫酸 |
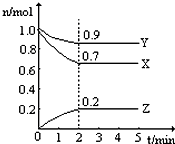 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: