题目内容
6.同周期的ⅡA族元素与ⅢA族元素的原子序数之差的绝对值( )| A. | 一定1 | B. | 一定是11 | C. | 一定是1或11 | D. | 以上均不正确 |
分析 同周期第ⅡA族与第ⅢA族元素,在短周期相邻,六、七周期中相隔副族、第ⅤⅢ,且ⅢB存在锕系、镧系元素,由此分析解答.
解答 解:ⅡA和ⅢA相隔有特殊性,若同在第二或三周期则原子序数相差1,若同在第四或五周期则原子序数相差11,若同在第六周期,则原子序数相差25,所以A、B、C都错误,故选D.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置是解答的关键,题目难度不大.

练习册系列答案
相关题目
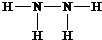 .
.
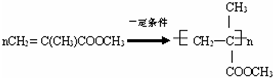
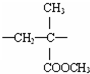
 乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.结合有关知识,回答下列问题:
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.结合有关知识,回答下列问题: .
.