题目内容
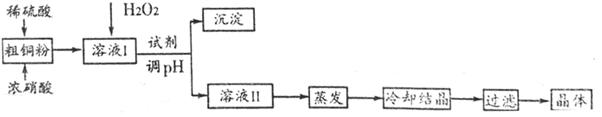
白云石的主要成分为CaCO3、MgCO3,还含有少量Fe、Si的化合物,实验室以白云石为原料制Mg(OH)2及CaCO3。步骤如下:
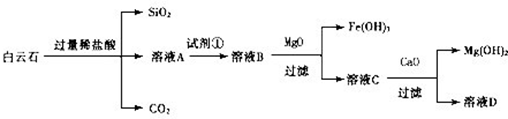
实验过程中需要的数据见下表:
请回答下列问题:
(1)过滤中所需的玻璃仪器是 。溶液A中含有Ca2+,Mg2+,Fe2+,Fe3+,则试剂①可选择
(填字母)
A.KMnO4 B.Cl2 C.H2O2
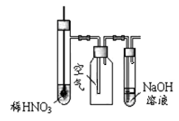
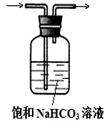
(2)若要利用反应过程中生成的CO2,从溶液D中制取CaCO3,需要先通入的一种气体是 ,然后通入CO2。通入CO2气体时请把右边的装置图补充完整(不允许更换溶液,导气管以下连接的仪器自选)。
(3)根据表中提供的数据判断,Fe(OH)3、Fe(OH)2和Mg(OH)2的溶度积常数由小到大的排列顺序为 。
(4)若将制取的Mg(OH)2:加入到某聚乙烯树脂中,树脂可燃性大大降低,Mg(OH)起阻燃作用的主要原因是 。

实验过程中需要的数据见下表:
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Mg2+ | 9.5 | 11.0 |
请回答下列问题:
(1)过滤中所需的玻璃仪器是 。溶液A中含有Ca2+,Mg2+,Fe2+,Fe3+,则试剂①可选择
(填字母)
A.KMnO4 B.Cl2 C.H2O2
(2)若要利用反应过程中生成的CO2,从溶液D中制取CaCO3,需要先通入的一种气体是 ,然后通入CO2。通入CO2气体时请把右边的装置图补充完整(不允许更换溶液,导气管以下连接的仪器自选)。
(3)根据表中提供的数据判断,Fe(OH)3、Fe(OH)2和Mg(OH)2的溶度积常数由小到大的排列顺序为 。

(4)若将制取的Mg(OH)2:加入到某聚乙烯树脂中,树脂可燃性大大降低,Mg(OH)起阻燃作用的主要原因是 。
(12分)(1)玻璃棒、烧杯、漏斗(2分);BC(2分)
(2)NH3(1分); (2分,使用干燥管也得分)
(2分,使用干燥管也得分)
(3) Ksp[Fe(OH)3]<Ksp[Fe(OH)2]<Ksp[Mg(OH)2](2分)
(4)Mg(OH)2受热分解时吸收大量的热,使环境温度下降;同时生成耐高温、稳定性好的MgO覆盖在可燃物表面,阻燃效果更佳。(2分,答出其中一个方面即可)
(2)NH3(1分);
 (2分,使用干燥管也得分)
(2分,使用干燥管也得分)(3) Ksp[Fe(OH)3]<Ksp[Fe(OH)2]<Ksp[Mg(OH)2](2分)
(4)Mg(OH)2受热分解时吸收大量的热,使环境温度下降;同时生成耐高温、稳定性好的MgO覆盖在可燃物表面,阻燃效果更佳。(2分,答出其中一个方面即可)
试题分析:根据流程可知,白云石加盐酸反应后的溶液中主要为氯化钙、氯化镁、氯化亚铁、氯化铁,加试剂①将亚铁离子氧化为铁离子,再加氧化镁除去铁离子,溶液C中主要含Ca2+、Mg2+,加CaO促进镁离子水解从而除去镁离子。
(1)过滤操作中的主要仪器是铁架台(带铁圈)、烧杯、玻璃棒、漏斗,因此主要的玻璃仪器是烧杯、玻璃棒、漏斗。由于选择氧化剂时不能引入新的杂质,高锰酸钾的还原产物是Mn2+,属于杂质,因此不能选择高锰酸钾溶液,所以试剂①为氯气或双氧水,即答案选B或C。
(2)CO2溶于水,溶液显酸性,不能和氯化钙反应生成白色沉淀。所以要制备碳酸钙沉淀,应该首先通入氨气,然后再通入CO2。由于氨水溶液显碱性,所以通入二氧化碳时应注意防止倒吸,因此正确的装置图可以为
 。
。(3)由表格中的数据可知,沉淀的pH越小,则溶度积越小。所以Fe(OH)3、Fe(OH)2和Mg(OH)2的溶度积常数由小到大的排列顺序Ksp[Fe(OH)3]<Ksp[Fe(OH)2]<Ksp[Mg(OH)2]。
(4)Mg(OH)2起阻燃作用的主要原因是Mg(OH)2受热分解时吸收大量的热,使环境温度下降;同时生成耐高温、稳定性好的MgO覆盖在可燃物表面,阻燃效果更佳。故答案为:Mg(OH)2受热分解时吸收大量的热,使环境温度下降;同时生成耐高温、稳定性好的MgO覆盖在可燃物表面,阻燃效果更佳.

练习册系列答案
相关题目
 N2O4(无色),减压时,气体颜色变浅,平衡向正反应方向移动
N2O4(无色),减压时,气体颜色变浅,平衡向正反应方向移动


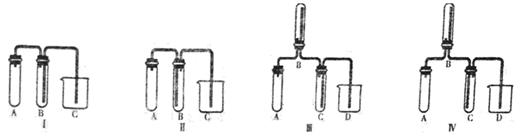
 图I 图II 图III 图IV
图I 图II 图III 图IV