题目内容
下列说法正确的是 ( )
A.0.lmol·L-l的醋酸加水稀释,c(H+)/c(OH-)减小
B. 体积相同、pH相同的醋酸和盐酸完全溶解等量的镁粉,后者用时少
C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大
D. VlLpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2
【答案】
A
【解析】
试题分析:醋酸是弱酸,存在电离平衡,稀释促进电离,但氢离子浓度是减小的,因此OH-的浓度是增大的,A正确;醋酸是弱酸,存在电离平衡,在pH相等的条件下,醋酸和锌的反应速率快,用时少,B不正确;水的离子积常数只与温度有关系,温度不变,离子积常数不变,C不正确;D中如果酸是强酸,则酸碱的溶液体积相等。如果酸是弱酸,则要使混合液显中性,则碱的体积必须大于酸的体积,D不正确,答案选A。
考点:考查弱电解质的电离、反应速率、水的离子积常数以及酸碱中和时溶液酸碱性的判断
点评:该题属于中等浓度的试题,难点在于外界条件对电离平衡的影响以及酸碱中和后溶液酸碱性的判断。外界条件对电离平衡的影响主要是依据勒夏特列原理进行判断,而酸碱中和后溶液酸碱性的判断,需要注意的是不能首先判断生成的盐是否水解,而是要先判断酸碱的过量问题。只有当酸碱恰好反应时,才能考虑生成的盐是否水解。

练习册系列答案
相关题目

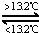 Sn(s,白)△H3=+2.1kJ?mol-1,
Sn(s,白)△H3=+2.1kJ?mol-1,