题目内容
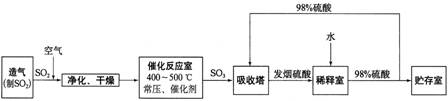
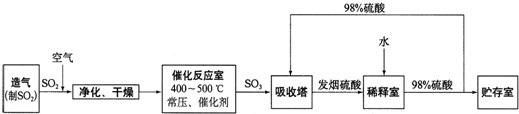
硫酸工业流程如下所示:
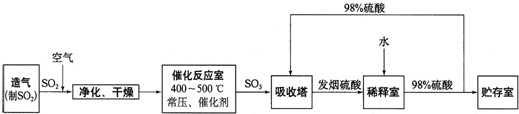
(1)催化反应室发生反应的化学方程式是:
该反应通常用V2O5作催化剂,其催化机理可能是:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被O2氧化.写出该催化循环机理的化学方程式:
(2)依据流程图判断下列说法正确的是
a.过量空气能提高SO2的转化率
b.使用催化剂能提高SO2的反应速率和转化率
c.用98%的硫酸吸收SO3,可以避免形成酸雾并提高吸收率
(3)每160g SO3气体与H2O(l)化合放出260.6kJ的热量,该反应的热化学方程式是
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理.这样做除了防止SO2污染环境并得到铵盐外,主要目的是:

(1)催化反应室发生反应的化学方程式是:
2SO2(g)+O2(g)
2SO3(g)
| ||
| △ |
2SO2(g)+O2(g)
2SO3(g)
.
| ||
| △ |
该反应通常用V2O5作催化剂,其催化机理可能是:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被O2氧化.写出该催化循环机理的化学方程式:
SO2+V2O5=SO3+2VO2、O2+4VO2=2V2O5
SO2+V2O5=SO3+2VO2、O2+4VO2=2V2O5
.(2)依据流程图判断下列说法正确的是
ac
ac
(填字母).a.过量空气能提高SO2的转化率
b.使用催化剂能提高SO2的反应速率和转化率
c.用98%的硫酸吸收SO3,可以避免形成酸雾并提高吸收率
(3)每160g SO3气体与H2O(l)化合放出260.6kJ的热量,该反应的热化学方程式是
SO3(g)+H2O(l)=H2SO4(l);△H=-130.3kJ/mol
SO3(g)+H2O(l)=H2SO4(l);△H=-130.3kJ/mol
.(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理.这样做除了防止SO2污染环境并得到铵盐外,主要目的是:
得到较高浓度的SO2,原料循环再利用
得到较高浓度的SO2,原料循环再利用
.分析:(1)催化反应室发生的反应是二氧化硫的催化氧化反应生成三氧化硫;该催化循环机理是V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被O2氧化为五氧化二钒;
(2)依据化学平衡影响因素和平衡移动原理和工业制备原理分析判断;
(3)每160g SO3气体与H2O(l)化合放出260.6kJ的热量,80g三氧化硫与水反应放热130.3KJ,依据热化学方程式的书写方法写出;
(4)用氨水吸收,再用浓硫酸处理是先生成亚硫酸铵,在和硫酸反应生成浓度高的二氧化硫,实现原料循环利用;
(2)依据化学平衡影响因素和平衡移动原理和工业制备原理分析判断;
(3)每160g SO3气体与H2O(l)化合放出260.6kJ的热量,80g三氧化硫与水反应放热130.3KJ,依据热化学方程式的书写方法写出;
(4)用氨水吸收,再用浓硫酸处理是先生成亚硫酸铵,在和硫酸反应生成浓度高的二氧化硫,实现原料循环利用;
解答:解:(1)催化反应室发生的反应是二氧化硫的催化氧化反应生成三氧化硫,反应的化学方程式为:2SO2(g)+O2(g)
2SO3(g);该催化循环机理是V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被O2氧化为五氧化二钒,反应的化学方程式为:SO2+V2O5=SO3+2VO2; O2+4VO2=2V2O5;
故答案为:2SO2(g)+O2(g)
2SO3(g);SO2+V2O5=SO3+2VO2; O2+4VO2=2V2O5;
(2)依据工业生产流程结合反应原理分析;
a.过量空气增大氧气浓度,能提高SO2的转化率,故a正确;
b.催化剂可以加快反应速率,平衡不动,但使用催化剂能不提高SO2的转化率,故b错误;
c.三氧化硫易溶于水,用98%的硫酸吸收SO3,可以避免形成酸雾并提高吸收率,故c正确;
故答案为:a、c;
(3)每160g SO3气体与H2O(l)化合放出260.6kJ的热量,80g三氧化硫与水反应放热130.3KJ,反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l);△H=-130.3kJ/mol;
故答案为:SO3(g)+H2O(l)=H2SO4(l);△H=-130.3kJ/mol;
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理.这样做吸收二氧化硫防止污染环境,得到高浓度的二氧化硫,除了防止SO2污染环境并得到铵盐外,能得到较高浓度的SO2,实现原料循环再利用;
故答案为:得到较高浓度的SO2,原料循环再利用;
| ||
| △ |
故答案为:2SO2(g)+O2(g)
| ||
| △ |
(2)依据工业生产流程结合反应原理分析;
a.过量空气增大氧气浓度,能提高SO2的转化率,故a正确;
b.催化剂可以加快反应速率,平衡不动,但使用催化剂能不提高SO2的转化率,故b错误;
c.三氧化硫易溶于水,用98%的硫酸吸收SO3,可以避免形成酸雾并提高吸收率,故c正确;
故答案为:a、c;
(3)每160g SO3气体与H2O(l)化合放出260.6kJ的热量,80g三氧化硫与水反应放热130.3KJ,反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l);△H=-130.3kJ/mol;
故答案为:SO3(g)+H2O(l)=H2SO4(l);△H=-130.3kJ/mol;
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理.这样做吸收二氧化硫防止污染环境,得到高浓度的二氧化硫,除了防止SO2污染环境并得到铵盐外,能得到较高浓度的SO2,实现原料循环再利用;
故答案为:得到较高浓度的SO2,原料循环再利用;
点评:本题考查了硫酸工业制备原理应用和注意问题,主要是催化剂的催化原理分析,热化学方程式书写,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目