题目内容
(10分)已知2X2(g)+Y2(g) 2Z(g) △H=-a kJ·mol-1(a>0),在一个容积固定的容器中加入2molX2和1mo1Y2,在500℃对充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
2Z(g) △H=-a kJ·mol-1(a>0),在一个容积固定的容器中加入2molX2和1mo1Y2,在500℃对充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
(1)此反应平衡常数表达式为____________________;若将温度降低到300℃,则反应平衡常数将______________(填增大、减少或不变)。
(2)若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度___________Wmol·L-1(填“>”、“<”或“=”),a,b、c之间满足关系___________(用代数式表示)。
(3)能说明反应已达平衡状态的是_____________________(从下列选项中选择)。
a.浓度c(Z)=2c(Y2) b.容器内压强保持不变
c.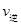 (X2)=2
(X2)=2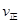 (Y2) d.容器内的密度保持不变
(Y2) d.容器内的密度保持不变
(4)若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2mol X2和lmol Y2达到平衡后,Y2的转化率将___________(填“变大”、“变小”或“不变”)。
 2Z(g) △H=-a kJ·mol-1(a>0),在一个容积固定的容器中加入2molX2和1mo1Y2,在500℃对充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
2Z(g) △H=-a kJ·mol-1(a>0),在一个容积固定的容器中加入2molX2和1mo1Y2,在500℃对充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。(1)此反应平衡常数表达式为____________________;若将温度降低到300℃,则反应平衡常数将______________(填增大、减少或不变)。
(2)若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度___________Wmol·L-1(填“>”、“<”或“=”),a,b、c之间满足关系___________(用代数式表示)。
(3)能说明反应已达平衡状态的是_____________________(从下列选项中选择)。
a.浓度c(Z)=2c(Y2) b.容器内压强保持不变
c.
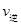 (X2)=2
(X2)=2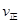 (Y2) d.容器内的密度保持不变
(Y2) d.容器内的密度保持不变(4)若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2mol X2和lmol Y2达到平衡后,Y2的转化率将___________(填“变大”、“变小”或“不变”)。
(1)K=  ;增大(各1分,共2分)
;增大(各1分,共2分)
(2)= ; a =" b" + c(各2分,共4分) (3)bc(2分) (4)变大(2分)
 ;增大(各1分,共2分)
;增大(各1分,共2分)(2)= ; a =" b" + c(各2分,共4分) (3)bc(2分) (4)变大(2分)
本题考查化学平衡常数、化学平衡状态的判断及影响化学平衡因素和相关计算。(1)由2X2(g)+Y2(g) 2Z(g)可知,平衡常数K=
2Z(g)可知,平衡常数K= ;由于该反应正反应放热,温度降低,平衡向正反应方向移动,平衡常数增大。(2)在500℃时,在一个容积固定的容器中加入2molX2和1mo1Y2和若原来容器中只加入2molZ属于等效平衡,故平衡时,Z浓度等于Wmol·L-1,a是生成2molZ时所放出的热量,b是生成Z的物质的量为W Vmol所放出的热量、c是消耗Z的物质的量为(2-WV)mol所吸收的热量,则它们之间的关系是2molZ=(2-WV)molZ+W VmolZ,故a =" b" + c;(3)判断达平衡状态的标志有两条——宏观标志(容积固定,体积不相等的反应,只要容器内压强保持不变就达到了平衡)和微观标志(正反应速率等于逆反应速率,即
;由于该反应正反应放热,温度降低,平衡向正反应方向移动,平衡常数增大。(2)在500℃时,在一个容积固定的容器中加入2molX2和1mo1Y2和若原来容器中只加入2molZ属于等效平衡,故平衡时,Z浓度等于Wmol·L-1,a是生成2molZ时所放出的热量,b是生成Z的物质的量为W Vmol所放出的热量、c是消耗Z的物质的量为(2-WV)mol所吸收的热量,则它们之间的关系是2molZ=(2-WV)molZ+W VmolZ,故a =" b" + c;(3)判断达平衡状态的标志有两条——宏观标志(容积固定,体积不相等的反应,只要容器内压强保持不变就达到了平衡)和微观标志(正反应速率等于逆反应速率,即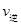 (X2)=2
(X2)=2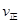 (Y2)),故选bc。(4)若将上述容器改为恒压容器(反应器开始体积相同),由于该反应正反应是体积 减小的反应,随反应的进行,压强减小,现在保持压强不变,相当于在原平衡的基础上加压,平衡向正反应方向移动,故Y2的转化率将变大。
(Y2)),故选bc。(4)若将上述容器改为恒压容器(反应器开始体积相同),由于该反应正反应是体积 减小的反应,随反应的进行,压强减小,现在保持压强不变,相当于在原平衡的基础上加压,平衡向正反应方向移动,故Y2的转化率将变大。
 2Z(g)可知,平衡常数K=
2Z(g)可知,平衡常数K= ;由于该反应正反应放热,温度降低,平衡向正反应方向移动,平衡常数增大。(2)在500℃时,在一个容积固定的容器中加入2molX2和1mo1Y2和若原来容器中只加入2molZ属于等效平衡,故平衡时,Z浓度等于Wmol·L-1,a是生成2molZ时所放出的热量,b是生成Z的物质的量为W Vmol所放出的热量、c是消耗Z的物质的量为(2-WV)mol所吸收的热量,则它们之间的关系是2molZ=(2-WV)molZ+W VmolZ,故a =" b" + c;(3)判断达平衡状态的标志有两条——宏观标志(容积固定,体积不相等的反应,只要容器内压强保持不变就达到了平衡)和微观标志(正反应速率等于逆反应速率,即
;由于该反应正反应放热,温度降低,平衡向正反应方向移动,平衡常数增大。(2)在500℃时,在一个容积固定的容器中加入2molX2和1mo1Y2和若原来容器中只加入2molZ属于等效平衡,故平衡时,Z浓度等于Wmol·L-1,a是生成2molZ时所放出的热量,b是生成Z的物质的量为W Vmol所放出的热量、c是消耗Z的物质的量为(2-WV)mol所吸收的热量,则它们之间的关系是2molZ=(2-WV)molZ+W VmolZ,故a =" b" + c;(3)判断达平衡状态的标志有两条——宏观标志(容积固定,体积不相等的反应,只要容器内压强保持不变就达到了平衡)和微观标志(正反应速率等于逆反应速率,即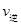 (X2)=2
(X2)=2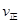 (Y2)),故选bc。(4)若将上述容器改为恒压容器(反应器开始体积相同),由于该反应正反应是体积 减小的反应,随反应的进行,压强减小,现在保持压强不变,相当于在原平衡的基础上加压,平衡向正反应方向移动,故Y2的转化率将变大。
(Y2)),故选bc。(4)若将上述容器改为恒压容器(反应器开始体积相同),由于该反应正反应是体积 减小的反应,随反应的进行,压强减小,现在保持压强不变,相当于在原平衡的基础上加压,平衡向正反应方向移动,故Y2的转化率将变大。
练习册系列答案
相关题目
 2HI(g)已经达到平衡状态的标志 (填序号)。
2HI(g)已经达到平衡状态的标志 (填序号)。 C(g)+D(g) 已达平衡的是
C(g)+D(g) 已达平衡的是 H2(g)+I2(g);DH>0,若降低温度,颜色加深,压强增大
H2(g)+I2(g);DH>0,若降低温度,颜色加深,压强增大 3A(g)+B(g)
3A(g)+B(g)  2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白: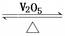 2SO3(g) ΔH<0。
2SO3(g) ΔH<0。
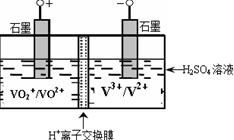
 2SO3(g) △H=-196kJ/mol。
2SO3(g) △H=-196kJ/mol。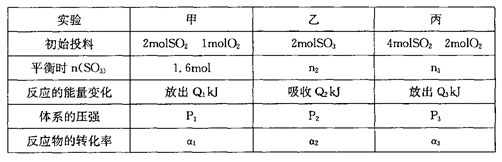
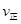 _______
_______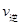
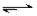 CO2(g)+H2(g) △H<0试回答下列问题:
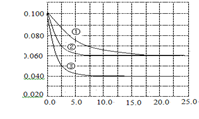
CO2(g)+H2(g) △H<0试回答下列问题: C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol·L-1,c(B)="0.200" mol·L-1,c(C)="0" mol·L-1。反应物A的浓度随时间的变化如右图所示。下列说法正确的是 ( )
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol·L-1,c(B)="0.200" mol·L-1,c(C)="0" mol·L-1。反应物A的浓度随时间的变化如右图所示。下列说法正确的是 ( )