题目内容
向100mL 6mol/L的AlCl3溶液中加入4mol/L NaOH溶液后得39g沉淀,此时消耗NaOH溶液的体积可能是多少?
考点:化学方程式的有关计算
专题:计算题
分析:据若碱不足,只发生Al3++3OH-═Al(OH)3↓;
若碱与铝离子的物质的量之比大于3:1,小于4:1,发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,据此讨论计算.
若碱与铝离子的物质的量之比大于3:1,小于4:1,发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,据此讨论计算.
解答:
解:沉淀的质量是39g,其物质的量为
=0.5mol,
(1)若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.5mol×3=1.5mol,
此时消耗NaOH溶液的体积为
=0.375L;
(2)若碱与铝离子的物质的量之比大于3:1,小于4:1,
则由 Al3++3OH-═Al(OH)3↓
0.6mol 1.8mol 0.6mol
Al(OH)3 +OH-═AlO2-+2H2O
(0.6-0.5)mol 0.1mol
则消耗的碱的物质的量为1.8mol+0.1mol=1.9mol,
此时消耗NaOH溶液的体积为
=0.475L;
答:消耗NaOH溶液的体积可能是0.375L和0.475L.
| 39g |
| 78g/mol |
(1)若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.5mol×3=1.5mol,
此时消耗NaOH溶液的体积为
| 1.5mol |
| 4mol/L |
(2)若碱与铝离子的物质的量之比大于3:1,小于4:1,
则由 Al3++3OH-═Al(OH)3↓
0.6mol 1.8mol 0.6mol
Al(OH)3 +OH-═AlO2-+2H2O
(0.6-0.5)mol 0.1mol
则消耗的碱的物质的量为1.8mol+0.1mol=1.9mol,
此时消耗NaOH溶液的体积为
| 1.9mol |
| 4mol/L |
答:消耗NaOH溶液的体积可能是0.375L和0.475L.
点评:本题考查铝离子与碱的反应,明确碱的量的多少对反应的影响及发生的化学反应是解答本题的关键,难度不大.

练习册系列答案
相关题目
下列实验操作正确的是( )
A、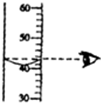 |
B、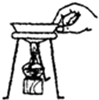 |
C、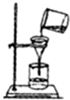 |
D、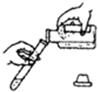 |
下列叙述中,错误的是( )
| A、硅广泛存在自然界中,天然单质硅叫硅石 |
| B、晶体硅结构类似于金刚石,硬度也很大 |
| C、氢氟酸能和玻璃发生化学反应,所以氢氟酸要存放在塑料瓶中 |
| D、烧碱液能腐蚀玻璃并生成硅酸钠,所以烧碱液要存放在带橡胶塞的玻璃瓶中 |
 已知,CH3CH2OH+NaBr+H2SO4
已知,CH3CH2OH+NaBr+H2SO4