题目内容
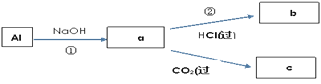
【题目】已知A是一种不溶于水的固体非金属氧化物,根据图中的转化关系,回答:
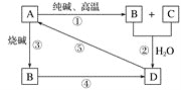
(1)A是______,B是_____,D是_____。
(2)写化学方程式:
①_________;
⑤_________。
(3)写离子方程式:
②__________;
③________;
④________。
【答案】SiO2 Na2SiO3 H2SiO3 Na2CO3+SiO2![]() Na2SiO3+CO2↑ H2SiO3
Na2SiO3+CO2↑ H2SiO3![]() H2O+SiO2 CO2+H2O+SiO32-=CO32-+H2SiO3↓ SiO2+2OH-=SiO32-+H2O SiO32-+2H+=H2SiO3↓
H2O+SiO2 CO2+H2O+SiO32-=CO32-+H2SiO3↓ SiO2+2OH-=SiO32-+H2O SiO32-+2H+=H2SiO3↓
【解析】
由“A是一种不溶于水的固体非金属氧化物”可推知A为SiO2,再结合SiO2的相关性质:SiO2跟Na2CO3在高温下反应生成Na2SiO3和CO2,二者在水中会反应生成H2SiO3沉淀,则D为H2SiO3,H2SiO3受热分解生成SiO2和H2O,说明A为SiO2是正确的,③为SiO2和NaOH的反应,可知B为Na2SiO3,则C为CO2,Na2SiO3可与酸反应生成硅酸,据此答题。
由以上分析可知A为SiO2,B为Na2SiO3,C为CO2,D为H2SiO3。
(1)由以上分析可知A为SiO2,B为Na2SiO3,D为H2SiO3,故答案为:SiO2;Na2SiO3; H2SiO3。
(2)①SiO2和碳酸钠在高温下反应生成硅酸钠和二氧化碳,反应的方程式为SiO2+Na2CO3![]() Na2SiO3+CO2↑,故答案为:SiO2+Na2CO3
Na2SiO3+CO2↑,故答案为:SiO2+Na2CO3![]() Na2SiO3+CO2↑。
Na2SiO3+CO2↑。
⑤H2SiO3受热分解生成SiO2和H2O,反应方程式为:H2SiO3![]() H2O+SiO2,故答案为:H2SiO3
H2O+SiO2,故答案为:H2SiO3![]() H2O+SiO2。
H2O+SiO2。
(3)②硅酸酸性比碳酸弱,硅酸钠和二氧化碳、水反应可生成硅酸,反应的方程式为Na2SiO3+CO2+H2O═H2SiO3↓+Na2CO3,离子方程式为:CO2+H2O+SiO32-=CO32-+H2SiO3↓,故答案为:CO2+H2O+SiO32-=CO32-+H2SiO3↓。
③二氧化硅和氢氧化钠反应生成硅酸钠和水,反应的化学方程式为SiO2+2NaOH═Na2SiO3+H2O,离子方程式为SiO2+2OH-═SiO32-+H2O,故答案为:SiO2+2OH-═SiO32-+H2O。
④Na2SiO3可与盐酸反应生成硅酸,方程式为Na2SiO3+2HCl═2NaCl+H2SiO3↓,离子方程式为:SiO32-+2H+=H2SiO3↓,故答案为:SiO32-+2H+=H2SiO3↓。

【题目】I.下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积KW | 1×10-14 | 1×10-13 | 1×10-12 |
试回答以下问题:
(1)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 molL-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=____________。
(2)在t2℃下,将a molL-1CH3COOH溶液与b molL-1NaOH溶液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH的电离常数Ka=____________(用a、b表示)。
II.已知:25℃下,下列反应:①Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq) △H=a kJmol-1 K=c;
Ag(NH3)2+(aq) △H=a kJmol-1 K=c;
②2Ag+(aq)+2OH-(aq)![]() Ag2O(s)+H2O(l) △H=b kJmol-1 K=d
Ag2O(s)+H2O(l) △H=b kJmol-1 K=d
(3)写出Ag2O溶于氨水(用NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:_____________;计算25℃下,该反应的平衡常数(用c、d表示)K=____________________。
III.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
离子 | Mg2+ | Cr3+ | Cl- |
浓度(mol/L) | 0.5 | 0.01 | a |
已知 25℃时,Ksp[Cr(OH)3]=10-32;Ksp[Mg (OH)2]=5×10-11;操作过程中溶液体积的变化忽略不计。
(4)表格中的a____________1.03(填“<”、“>”或“=”)。
(5)除去杂质Cr3+离,可加入MgO调节溶液pH,理论上应调节pH的范围是_______________。
(6)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl26H2O)的操作是___________________。