题目内容
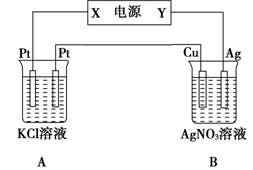
苯乙烯是重要的基础有机原料。工业中用乙苯(C6 H5- CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5- CH= CH2)的反应方程式为:
C6 H5- CH2 CH3 (g) C6 H5- CH=CH2 (g) +H2(g) ΔH1
C6 H5- CH=CH2 (g) +H2(g) ΔH1
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示: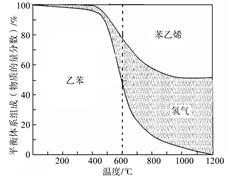
由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
① 氢气的物质的量分数为 ;乙苯的物质的量分数为 ;
② 乙苯的平衡转化率为 ;
③ 计算此温度下该反应的平衡常数(请写出计算过程)。
(2) 分析上述平衡体系组成与温度的关系图可知:△H1 0(填“>、=或<” )。
(3)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率 30%(填“>、=、<” )。
(4)已知:
3C2 H2 (g)  C6 H6 (g) ΔH2
C6 H6 (g) ΔH2
C6 H6 (g) + C2H4 (g)  C6 H5- CH2CH3 (g) ΔH3
C6 H5- CH2CH3 (g) ΔH3
则反应3C2H2 (g)+ C2H4 (g)  C6 H5- CH=CH2 (g) +H2(g) 的ΔH= 。
C6 H5- CH=CH2 (g) +H2(g) 的ΔH= 。
(1)①25% ; 50% (共4分,各2分) ②33% (2分)
③(共4分) C6 H5- CH2 CH3 (g)  C6 H5- CH=CH2 (g) + H2(g)
C6 H5- CH=CH2 (g) + H2(g)
起始浓度/( mol?L-1) : a/V 0 0
变化浓度/( mol?L-1) : a/3V a/3V a/3V
平衡浓度/( mol?L-1) : 2a/3V a/3V a/3V(2分)
K =( a/3V? a/3V)/ (2a/3V) = a/6V (2分)
(2)> (2分) ;
(3)> (2分) ;
(4)ΔH1+ΔH2+ΔH3 (2分)
解析试题分析:(1)①从图中可判断乙苯的物质的量分数是50%,设消耗乙苯xmol,则生成苯乙烯和氢气各xmol,所以余(a-x)mol乙苯,则(a-x)mol/(a-x)mol+2xmol=0.5,解得x=1/3amol,所以氢气的物质的量分数是1/3a/(a+1/3a)×100%=25%;
②乙苯的平衡转化率为1/3a÷a×100%=33%;
③平衡常数大等于平衡时生成物的浓度幂之积除以反应物的浓度幂之积,首先计算三种物质的平衡浓度,由①分析得平衡时乙苯的物质的量是a-1/3a=2/3a,苯乙烯、氢气的物质的量都是1/3a,容器体积为VL,所以K=( a/3V? a/3V)/ (2a/3V) = a/6V,计算过程如下(三段式法)
C6 H5- CH2 CH3 (g)  C6 H5- CH=CH2 (g) + H2(g)
C6 H5- CH=CH2 (g) + H2(g)
起始浓度/( mol?L-1) : a/V 0 0
变化浓度/( mol?L-1) : a/3V a/3V a/3V
平衡浓度/( mol?L-1) : 2a/3V a/3V a/3V
K =( a/3V? a/3V)/ (2a/3V) = a/6V
(2)杨浦图判断,温度升高乙苯的物质的量分数减小,说明升温平衡正向移动,所以正向是吸热反应△H1>0;
(3)温度不变,加入稀释剂水蒸气并保持体系总压为101.3kPa,则容器体积增大,相当于给反应体系降低压强,平衡正向移动,所以再次平衡时乙苯的转化率>30%;
(4)根据盖斯定律,将已知三个热化学方程式相加即得所求方程式,则所求热效应也等于三式的热效应相加,所以ΔH=ΔH1+ΔH2+ΔH3。
考点:考查对图像的分析,混合体系中组分的物质的量分数的计算、转化率的计算,平衡的移动的判断,盖斯定律的应用

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案(14分)合成氨是人类研究的重要课题,目前工业合成氨的原理为:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
相持恒温、恒容,测的反应达到平衡时关系数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2mol NH3 |
| 达到平衡的时间/min | | 6 | 8 |
| 平衡时 N2的体积密度 | C1 | 1.5 | |
| 混合气体密度/g·L-1 | 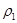 |  | |
| 平衡常数/ L2·mol-2 | K甲 | K乙 | K丙 |
a.容器内H2、N2、NH3的浓度只比为1:3:2 b.容器内压强保持不变
c.
 d.混合气体的密度保持不变
d.混合气体的密度保持不变e.混合气体的平均相对分子质量不变
(2)容器乙中反应从开始到达平衡的反应速度为
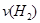 =
= (3)在该温度下甲容器中反应的平衡常数K (用含C1的代数式表示)
(4)分析上表数据,下列关系正确的是 (填序号):
a.
 b.氮气的转化率:
b.氮气的转化率: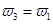 c.
c. 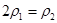 d.
d.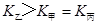
(5)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热△H=-286KJ/mol,则由次原理制NH3反应的热化学方程式为
(6)希腊阿里斯多德大学的George Mamellos和Michacl Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氨气稀释的氮气分别通入一个加热到
 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。 Ⅰ.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。下表为一些化学键的键能数据
| 化学键 | Si-Si | O=O | Si-O |
| 键能/kJ·mol-1 | a | b | c |
写出硅高温燃烧的热化学方程式 。
Ⅱ.利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如右图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。写出下列电解池中总反应的离子方程式:
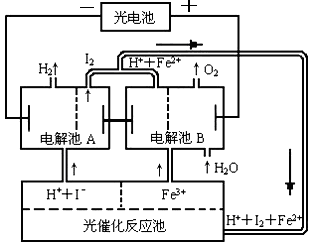
电解池A 。
电解池B 。
(2)若电解池A中生成3.36 L H2(标准状况),计算电解池B中生成Fe2+的物质的量为 mol。
Ⅲ.在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g)
 2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。
2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。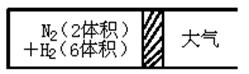
请据此回答下列问题:
(1)保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。
①a=1,c=2,则b= 。在此情况下,反应起始时将向 反应方向(填“正”或“逆”)进行。
②若需规定起始时反应向逆方向进行,则c的取值范围是 。
(2)在上述恒压装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是 ,原因是 。
根据下列条件计算有关反应的焓变:
(1)已知:
Ti(s)+2Cl2(g)===TiCl4(l) ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)==="2NaCl(s)" ΔH=-882.0 kJ·mol-1
Na(s)===Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)===Ti(s)+4NaCl(s)的ΔH= kJ·mol-1。
(2)已知下列反应数值:
| 序号 | 化学反应 | 反应热 |
| ① | Fe2O3(s)+3CO(g)=== 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
| ② | 3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol-1 |
| ③ | Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
| ④ | FeO(s)+CO(g)===Fe(s)+CO2(g) | ΔH4 |
则反应④的ΔH4= kJ·mol-1。
 CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1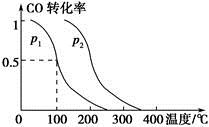
 CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________________________
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________________________
 CH3OH(g)ΔH=-90.7 kJ/mol ①
CH3OH(g)ΔH=-90.7 kJ/mol ① O2(g)
O2(g) 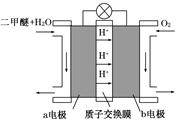
 2NH3(g)ΔH=-92.2kJ·mol-1
2NH3(g)ΔH=-92.2kJ·mol-1
 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为: O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1