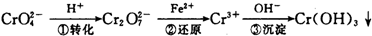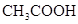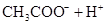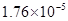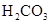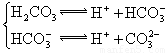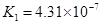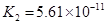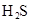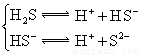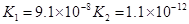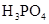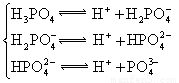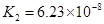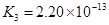题目内容
计算下列溶液的PH值:
⑴若PH为2和PH为4两盐酸等体积混合,则混合后PH= 。
⑵若PH为8和PH为13两NaOH溶液等体积混合,则混合后PH= 。
⑶若PH为13的强碱溶液和PH为2的强酸溶液以1∶9体积比混合,则混合后PH= 。
⑴2.3;⑵12.7;⑶11
解析:
求强酸与强碱混合后溶液的PH的计算大使,应注意酸先求混合后的[H+],碱应先求混合后的[![]() ],酸碱混合,首先确定是否完全反应,再计算混合后的[H+],最后求PH。 ⑴PH=2,[H+]=
],酸碱混合,首先确定是否完全反应,再计算混合后的[H+],最后求PH。 ⑴PH=2,[H+]=![]() mol/L,PH=4,[H+]=
mol/L,PH=4,[H+]=![]() mol/L,取体积为1L,则有:
mol/L,取体积为1L,则有:
[H+]混=![]() =5×
=5×![]() mol/L,
mol/L,
即:PH混=-lg(5×![]() )=3-lg5=2.3。
)=3-lg5=2.3。
⑵PH=8,[H+]=![]() mol/L,[
mol/L,[![]() ]=
]=![]() mol/L;PH=13,[H+]=
mol/L;PH=13,[H+]=![]() mol/L,[
mol/L,[![]() ]=
]=![]() mol/L,取体积为1L,则有:
mol/L,取体积为1L,则有:
[![]() ]混=
]混=![]() =5×
=5×![]() mol/L,
mol/L,
即:[H+]混=![]() =2×
=2×![]() mol/L,PH=-lg(2×
mol/L,PH=-lg(2×![]() )=12.7。
)=12.7。
⑶先判断碱过量,则依题意得:碱PH=13,[H+]=![]() mol/L,[
mol/L,[![]() ]=
]=![]() mol/L,取体积为1L,酸PH=2,[H+]=
mol/L,取体积为1L,酸PH=2,[H+]=![]() mol/L,取体积为9L,即:[
mol/L,取体积为9L,即:[![]() ]混=
]混=![]() =
=![]() =1×
=1×![]() mol/L,
mol/L,
[H+]混=![]() =1×
=1×![]() mol/L,PH=-lg(1×
mol/L,PH=-lg(1×![]() )=11。
)=11。

对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表是25℃时几种常见弱酸的电离平衡常数
|
酸 |
电离方程式 |
电离平衡常数K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
回答下列各问:
(1)K只与温度有关,当温度升高时,K值________(填“增大”、“减小”、“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?__________________.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是_________,最弱的是________.
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数.对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,对于H3PO4此规律是________________,产生此规律的原因是_________________________.
 (5)电离平衡常数是用实验的方法测定出来的.现已经测得某温度下 NH3∙H2O溶液中存在如下反应:NH3∙H2O NH4++OH-
已知0.10 mol·L-1
NH3∙H2O溶液中,达到平衡时,C平衡(OH-)=4.2 × 10-3mol·L-1,C平衡(NH3∙H2O)≈C起始(NH3∙H2O),水的电离可忽略不计;
(5)电离平衡常数是用实验的方法测定出来的.现已经测得某温度下 NH3∙H2O溶液中存在如下反应:NH3∙H2O NH4++OH-
已知0.10 mol·L-1
NH3∙H2O溶液中,达到平衡时,C平衡(OH-)=4.2 × 10-3mol·L-1,C平衡(NH3∙H2O)≈C起始(NH3∙H2O),水的电离可忽略不计;
①用pH试纸测量溶液的pH值,即可求得C平衡(OH-),测定溶液pH值的操作是______________。
②测量C平衡(NH3∙H2O)的方法最好用_____________法(填方法名称)
③求此温度下该反应的平衡常数K.(写出计算过程,计算结果保留2位有效数字)
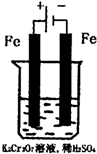 环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO
环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO