题目内容
某酸性溶液中只有Na+、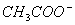 、H+、
、H+、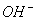 四种离子。则下列描述正确的是( )
四种离子。则下列描述正确的是( )
A.该溶液由pH=3的CH3COOH与pH=2013的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量的NaOH,溶液中离子浓度为c(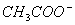 )>c(Na+)>c(OH-)>c(H+)
)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(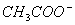 )一定大于c(Na+)、c(NH4+)之和
)一定大于c(Na+)、c(NH4+)之和
【答案】A
【解析】此题的关键应注意题中的“酸性”两个字,选项B溶液NaOH与CH3COOH恰好完全反应,所以溶液呈碱性;选项C中当加入NaOH后溶液仍然呈酸性,则c(H+)>c(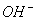 ),不成立,当恰好完全反应,溶液呈碱性,则c(Na+)>C(
),不成立,当恰好完全反应,溶液呈碱性,则c(Na+)>C(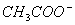 ),当碱过量时,必定c(Na+)>C(
),当碱过量时,必定c(Na+)>C(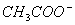 ),所以在任何情况下溶液的离子关系都不能成立;选项D中加入氨水,由电荷守恒得:c(
),所以在任何情况下溶液的离子关系都不能成立;选项D中加入氨水,由电荷守恒得:c(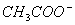 )+c(OH-)=c(Na+)+c(NH4+)+c(H+),当溶液仍呈酸性即c(OH-)<c(H+),则c(
)+c(OH-)=c(Na+)+c(NH4+)+c(H+),当溶液仍呈酸性即c(OH-)<c(H+),则c(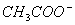 )>c(NH4+)+c(Na+);当溶液呈中性时,c(H+)=c(OH-),则c(
)>c(NH4+)+c(Na+);当溶液呈中性时,c(H+)=c(OH-),则c(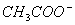 )=c(
)=c(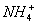 )+c(Na+);当溶液呈碱性时,c(H+)<c(
)+c(Na+);当溶液呈碱性时,c(H+)<c(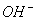 ),则c(
),则c(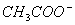 )<c(
)<c(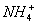 )+c(Na+),所以c(
)+c(Na+),所以c(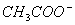 )一不定大于c(Na+)、c(
)一不定大于c(Na+)、c(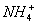 )之和。
)之和。
【考点分析】溶液中离子浓度大小比较。

 名校课堂系列答案
名校课堂系列答案关于物质分类的正确组合是( )
| 分类 组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | Na2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO |
| C | NaOH | CH3COOH | MgCl2 | CO2 | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO3 |
某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4Ba(NO3)2、AgNO3和CuSO4,将该混合物进行如下实验,根据所给实验现象完成表格(对于可能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”)。
(1)将少许固体放入水中得到无色溶液和白色沉淀。
| 肯定存在的物质 | 肯定不存在的物质 | 理由 |
(2)取溶液进行焰色反应,火焰呈黄色。
| 肯定存在的物质 | 肯定不存在的物质 | 理由 |
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
| 肯定存在的物质 | 肯定不存在的物质 | 理由 |
(4)通过上述实验仍无法确定的物质是__________________。
 2HI(g),在一定温度下由H2(g)和I2(g)开始反应,下列说法正确的是( )
2HI(g),在一定温度下由H2(g)和I2(g)开始反应,下列说法正确的是( )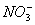 、
、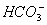
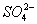 、NH3·H2O
、NH3·H2O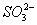 、Cl2
、Cl2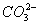 、
、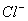 、
、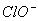
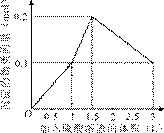
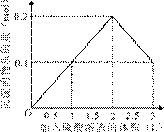
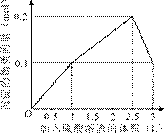
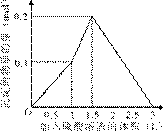
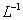 的盐酸滴定0.12 mol•.
的盐酸滴定0.12 mol•.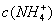 >
>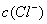 ,
,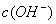 >
>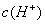 B.
B.