题目内容
对于可逆反应H2(g)+I2(g) 2HI(g),在一定温度下由H2(g)和I2(g)开始反应,下列说法正确的是( )
2HI(g),在一定温度下由H2(g)和I2(g)开始反应,下列说法正确的是( )
A.H2(g)的消耗速率与HI(g)的生成速率之比为2∶1
B.反应进行的净速率是正、逆反应速率之差
C.正、逆反应速率的比值是恒定的
D.达到平衡时,一定有c(H2) = c(HI)
B

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ |
| 阴离子 | C1- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是 。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是 。
(3)甲同学最终确定原溶液中所含阳离子有 ,阴离子有 ;并据此推测原溶液应该呈 性,原因是 (请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为
。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为 g。
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5 mol·L-1 ;H2CO3的电离常数
Ka1=4.2×10-7mol·L-1 、 Ka2=5.6×10-11mol·L-1
(1)常温下,物质的量浓度相同的下列四种溶液: a、氢氧化钡溶液b、氢氧化钠溶液c、碳酸钠溶液d、碳酸氢钠溶液e、醋酸钠溶液。其PH由大到小的顺序是: (填序号)。
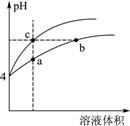 (2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是 ;该醋酸溶液稀释过程中,下列各量一定变小的是 。
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是 ;该醋酸溶液稀释过程中,下列各量一定变小的是 。
a.c(H+) b.c(OH-)
c.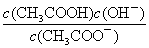 d.
d.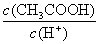
(3)以0.10 mol·L-1NaOH为标准液,测定某盐酸的浓度。取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | 氢氧化钠溶液的浓度(mol·L-1) | 滴定完成时,氢氧化钠溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 24.12 | 20.00 |
| 2 | 0.10 | 23. 88 | 20.00 |
| 3 | 0.10 | 24.00 | 20.00 |
①滴定达到终点的标志是___________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________________。
⑷在t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,
已知a+b=12,则:
①该温度下水的离子积常数Kw= mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= 。
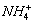



 I-
I- CO(NH2)2(s)+H2O(g) ΔH<0
CO(NH2)2(s)+H2O(g) ΔH<0
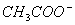 、H+、
、H+、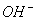 四种离子。则下列描述正确的是( )
四种离子。则下列描述正确的是( )