题目内容
【题目】(1)科研人员设想用如图所示装置生产硫酸。
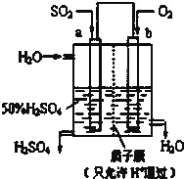
①上述生产硫酸的总反应方程式为_____,b是_____极,a电极反应式为_____,生产过程中H+向_____(填a或b)电极区域运动。
②该小组同学反思原电池的原理,其中观点正确的是_____(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原申池装置需要2个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成原电池装置,则负极材料为_____,溶液C为_____。
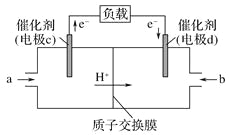
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜(只允许H+通过)燃料电池的结构示意图如:电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为_____(填“正极”或“负极”),c电极反应方程式为_________。
【答案】2SO2+O2+2H2O=2H2SO4 ![]() SO2-2e-+2H2O=4H++SO42- b D Cu FeCl3溶液 负 CH3OH-6e-+H2O=CO2+6H+
SO2-2e-+2H2O=4H++SO42- b D Cu FeCl3溶液 负 CH3OH-6e-+H2O=CO2+6H+
【解析】
(1)原电池中负极失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此判断;
(2)根据原电池的工作原理分析解答;
(3)根据电子的移动方向判断正负极,进而书写电极反应式。
(1)①根据装置图可知a电极通入二氧化硫,二氧化硫发生失去电子的氧化反应,氧气在正极通入,因此上述生产硫酸的总反应方程式为2SO2+O2+2H2O=2H2SO4,b通入氧气,是正极,a电极是负极,反应式为SO2-2e-+2H2O=4H++SO42-,原电池中阳离子向正极移动,则生产过程中H+向b电极区域运动。
②A.原电池反应的过程中一定有电子发生转移,A错误;
B.原申池装置不一定需要2个活泼性不同的金属电极,例如燃料电池等,B错误;
C.原电池中电极可以参加反应,例如铜、锌、稀硫酸组成的原电池中锌电极参加反应,C错误;
D.原电池中氧化反应和还原反应可以拆开在两极发生,D正确;
答案选D。
(2)根据反应Cu+2Fe3+=Cu2++2Fe2+可知铜失去电子,铁离子得到电子,则设计成原电池装置时负极材料为Cu,溶液C为氯化铁溶液。
(3)根据装置图可知电子从c电极流出,则c电极是负极,电池总反应为2CH3OH+3O2=2CO2+4H2O,所以甲醇在负极发生失去电子的氧化反应转化为二氧化碳,则c电极反应方程式为CH3OH-6e-+H2O=CO2+6H+。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)化学性质最不活泼的元素原子的原子结构示意图为________;
(2)比较元素①、②的简单氢化物的稳定性______________________(用化学式表示);
(3)元素的最高价氧化物对应的水化物中酸性最强的是________,碱性最强的是_______,呈两性的氢氧化物是_______________,(填写化学式) 元素③的最高价氧化物对应水化物中含有的化学键类型为________________;
(4)在③~⑦元素中,简单离子半径最小的是_________;
(5) Na2O2的电子式为___________;CO2的电子式为_________;
(6)在⑦与⑩的单质中,氧化性较强的是_______________,用化学反应方程式证明:_____________________________。