题目内容
25℃、101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量,下列表示甲醇燃烧热的热方程式是
A.CH4O(l)+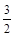 O2(g)==CO2(g)+2H2O(l);△H=-725.8kJ· mol—1 O2(g)==CO2(g)+2H2O(l);△H=-725.8kJ· mol—1 |
| B.2CH4O(l)+3O2(g)==2CO2(g)+4H2O(l);△H=+1451.6kJ· mol—1 |
| C.2CH4O(l)+3O2(g)==2CO2(g)+4H2O(l);△H=-22.68kJ· mol—1 |
D.CH4O(l)+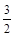 O2(g)==CO2(g)+2H2O(g);△H=-725.8kJ· mol—1 O2(g)==CO2(g)+2H2O(g);△H=-725.8kJ· mol—1 |
A
试题分析:1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量,则1mol甲醇即16甲醇完全燃烧放出的热量是22.68kJ×16=725.8kJ。燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,据此可知选项A正确,B中反应热大于0,错误;C中反应热的数值不正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度试题的考查,试题基础性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和应试能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确燃烧热的含义以及热化学方程式书写的注意事项,然后灵活运用即可。

练习册系列答案
相关题目


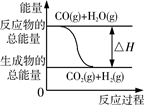
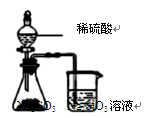
 CO2(g)+H2(g)的△H大于0
CO2(g)+H2(g)的△H大于0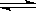 2NH3 △H<0。有甲、乙两个完全相同的容器,向甲容器中加入1molN2和3 molH2,在一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 molNH3,达平衡时,吸收的热量为Q2。已知Q2=3Q1,则甲容器中,H2的转化率为
2NH3 △H<0。有甲、乙两个完全相同的容器,向甲容器中加入1molN2和3 molH2,在一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 molNH3,达平衡时,吸收的热量为Q2。已知Q2=3Q1,则甲容器中,H2的转化率为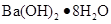 与
与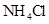 的反应
的反应