题目内容
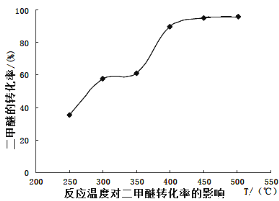
【题目】第ⅥA族的氧、硫、硒、碲等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
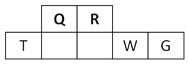
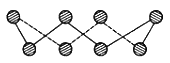
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是_____;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为_______;
(3)Se原子序数为____,其核外M层电子的排布式为____;
(4)H2Se的酸性比H2S___(填“强”或“弱”)。气态SeO3分子的立体构型为___,SO32-离子的立体构型为______;SO32-离子中S原子的杂化方式为____________。
【答案】 sp3 O>S>Se 34 3s23p63d10 强 平面三角形 三角锥形 sp3
【解析】本题综合考查物质结构与性质相关知识,涉及杂化轨道、第一电离能、电子排布式、分子的立体构型等知识,根据基础知识解答。
(1)由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4,因此S原子采用的杂化轨道方式为sp3。
(2)同主族元素从上到下元素的第一电离能逐渐减小,则第一电离能由大到小的顺序为O>S>Se。
(3)Se位于元素周期表第四周期第ⅥA族,原子序数为34,其核外电子排布式为1s22s22p63s23p63d104s24p4,所以核外M层电子的排布式为3s23p63d10。
(4)同主族元素对应的氢化物中,元素的非金属性越强,对应的氢化物的酸性越弱,则H2Se的酸性比H2S强;气态SeO3分子中Se形成3个δ键,没有孤电子对,为平面三角形分子;SO32-中S形成3个δ键,孤电子对数为(6+2-2×3)÷2=1,则为三角锥形;价层电子对数为4,则SO32-离子中S原子的杂化方式为sp3杂化。

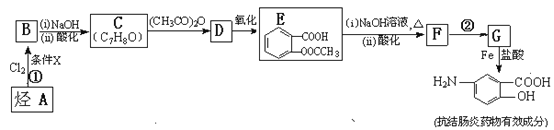
【题目】【化学——选修5:有机化学基础】某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):
![]()
根据以上信息回答下列问题:
(1)烃A的结构简式是 。
(2)①的反应条件是 。②的反应类型是 。
(3)下列对抗结肠炎药物有效成分可能具有的性质推测正确的是: 。
A.水溶性比苯酚好,密度比苯酚的大 |
B.能发生消去反应 |
C.能发生聚合反应 |
D.既有酸性又有碱性 |
(4)E与足量NaOH溶液反应的化学方程式是 。
(5)写出所有符合下列条件的E的同分异构体的结构简式: 。
a.与E具有相同的官能团
b.苯环上的一硝基取代产物有两种
(6)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料合成化合物![]() 的合成路线 。(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
的合成路线 。(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
【题目】尿素/H2O2溶液可用于烟气的脱硫脱硝。
(1)已知T℃时,2SO2(g)+O2(g) ![]() 2SO3(g) △H1
2SO3(g) △H1
2H2O2(I)=2H2O(I)+O2(g) △H2
SO3(g)+H2O(I))=H2SO4(I) △H3
则SO2(g)+H2O2(I))=H2SO4(I) △H4=__________ (用含△H1、△H2、△H3的代数式表示)
(2)尿素[CO(NH2)2]溶液对NOx及SO2有一定的脱除率。将SO2和NOx (N〇约占90%)通入氧气的体积分数为7%、尿素浓度为5%的反应器中进行反应。
①烟气中SO2最终转化为一种正盐,其化学式为______________;NO和NO2以物质的量之比1:1与CO(NH2)2反应生成无毒气体的化学方程式为_________________________。
②氨基甲酸铵(H2NCOONH4)是尿素的水解产物,将一定量的氨基甲酸铵置于恒容密闭容器中,发生反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
温度/K | 338 | 343 | 348 | 353 |
平衡时气体的总浓度/mol L-1 | 0.36 | 0.48 | 0.60 | 0.72 |
该反应的△H__________(填“>”或“<”)0;348K时,该反应的平衡常数K__________________。
(3)其他条件不变,向尿素溶液中添加H2O2溶液,测得不同 pH下氮氧化物的脱除率与时间的关系如图
所示。
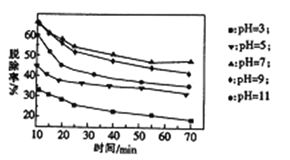
①NO与H2O2发生反应生成亚硝酸时,氧化剂与还原剂的物质的量之比为____________。
②脱硝时,最佳pH为_________;在碱性较强时,NOx脱除率降低,其原因是_____________________
(任写一点)。