题目内容
15. 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.(1)当反应达到平衡时,N2和H2的浓度比是1:3,N2和H2的转化率比是1:1.
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变小(填“变大”“变小”或“不变”).
(3)当达到平衡时,充入氩气并保持压强不变,平衡将逆向(填“正向”“逆向”或“不”)移动.
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将向左移动(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度小于(填“大于”“小于”或“等于”)原来的2倍.
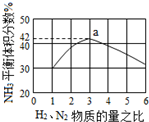
(5)如图表示工业500℃、60.0MPa条件下合成氨,原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数:14.5%.
(6)在25℃下,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-);用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{10-9}{a-0.01}$.
分析 (1)N2、H2起始物质的量之比等于化学计量数之比,则平衡时N2、H2物质的量浓度之比等于化学计量数之比,转化率相等;
(2)该反应的正反应是放热反应,升高平衡体系的温度,平衡逆向移动,则混合气体物质的量增大,混合气体质量不变,根据M=$\frac{m}{n}$判断其相对分子质量变化;
(3)当达到平衡时,充入氩气并保持压强不变,导致反应物和生成物的分压减小,平衡向气体体积增大方向移动;
(4)该反应的正反应是放热反应,升高温度平衡向吸热方向移动;逆向移动导致吸收部分热量;
(5)a点反应前氢气和氮气的物质的量之比为3:1,平衡时氨气体积分数为42%,相同条件下物质的体积分数等于其物质的量分数,
设参加反应的氢气、氮气物质的量分别为3mol、1mol,平衡时氮气的物质的量为xmol,
N2(g)+3H2(g)?2NH3(g)
开始(mol)1 3 0
反应(mol)1-x 3(1-x) 2(1-x)
平衡(mol)x 3x 2(1-x)
氨气的体积分数等于其物质的量分数=$\frac{2(1-x)mol}{(x+3x+2-2x)mol}$×100%=42%
x=$\frac{29}{71}$,
氮气的体积分数=$\frac{xmol}{(x+3x+2-2x)mol}×100%$;
(6)混合溶液中c(NH4+)=c(Cl-),根据电荷守恒得c(H+)=c(OH-),溶液呈中性,溶液中c(H+)=c(OH-)=10-7mol/L,二者混合后溶液体积增大一倍,则c(Cl-)变为原来的一半,为0.005mol/L,混合溶液中c(NH4+)=c(Cl-)=0.005mol/L,一水合氨电离平衡常数Kb=$\frac{c(O{H}^{-}).c(N{{H}_{4}}^{+})}{c(N{H}_{3}.{H}_{2}O)}$.
解答 解:(1)N2、H2起始物质的量之比等于化学计量数之比,则平衡时N2、H2物质的量浓度之比等于化学计量数之比为1:3,转化率相等,所以其转化率之比为1:1,
故答案为:1:3;1:1;
(2)该反应的正反应是放热反应,升高平衡体系的温度,平衡逆向移动,则混合气体物质的量增大,混合气体质量不变,M=$\frac{m}{n}$知其相对分子质量变小,故答案为:变小;
(3)当达到平衡时,充入氩气并保持压强不变,导致反应物和生成物的分压减小,平衡向气体体积增大方向移动,则平衡逆向移动,故答案为:逆向移动;
(4)该反应的正反应是放热反应,升高温度平衡向吸热方向移动,所以平衡向左移动;逆向移动导致吸收部分热量,则达到新平衡后,容器内温度小于原来的2倍,
故答案为:向左移动;小于;
(5)a点反应前氢气和氮气的物质的量之比为3:1,平衡时氨气体积分数为42%,相同条件下物质的体积分数等于其物质的量分数,
设参加反应的氢气、氮气物质的量分别为3mol、1mol,平衡时氮气的物质的量为xmol,
N2(g)+3H2(g)?2NH3(g)
开始(mol)1 3 0
反应(mol)1-x 3(1-x) 2(1-x)
平衡(mol)x 3x 2(1-x)
氨气的体积分数等于其物质的量分数=$\frac{2(1-x)mol}{(x+3x+2-2x)mol}$×100%=42%
x=$\frac{29}{71}$,
氮气的体积分数=$\frac{xmol}{(x+3x+2-2x)mol}×100%$=$\frac{\frac{29}{71}mol}{2(1+\frac{29}{71})mol}$×100%=14.5%,
故答案为:14.5%;
(6)混合溶液中c(NH4+)=c(Cl-),根据电荷守恒得c(H+)=c(OH-),溶液呈中性,溶液中c(H+)=c(OH-)=10-7mol/L,二者混合后溶液体积增大一倍,则c(Cl-)变为原来的一半,为0.005mol/L,混合溶液中c(NH4+)=c(Cl-)=0.005mol/L,一水合氨电离平衡常数Kb=$\frac{c(O{H}^{-}).c(N{{H}_{4}}^{+})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{1{0}^{-7}×0.005}{(\frac{a}{2}-0.005)}$=$\frac{10-9}{a-0.01}$,故答案为:$\frac{10-9}{a-0.01}$.
点评 本题考查化学平衡计算、化学平衡影响因素、弱电解质的电离等知识点,侧重考查学生计算及知识运用能力,注意三段式法在化学平衡计算中的灵活运用,难点是(6)题计算,注意二者混合时溶液体积增大一倍导致物质浓度降为原来的一半,为易错点.

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案| A. | CO2 是氧化产物 | |
| B. | 1mol KClO3 参加反应,转移的电子为1mol | |
| C. | KClO3 在反应中被氧化 | |
| D. | H2C2O4的还原性强于ClO2 的还原性 |
Ⅰ.回收硫
(1)工业上,采用饱和亚硫酸钠溶液吸收烟气中二氧化硫,写出离子方程式:SO2+SO32-+H2O=2HSO3-.然后,加热吸收液收集SO2.将二氧化硫、空气在稀硫酸中构成原电池,负极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ.冶炼铜
(2)工业上,火法冶炼铜分两步:第一步,含铜矿(主要成分是Cu2S)在空气中煅烧生成氧化亚铜和刺激性气味气体;第二步,氧化亚铜和铜矿在高温下反应生成铜和刺激性气体.写出冶炼铜的总反应方程式:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
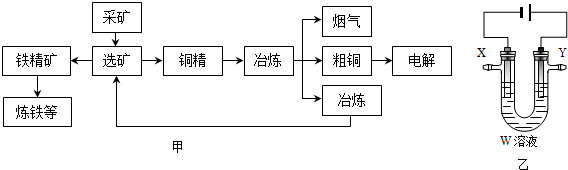
(3)用电解法精炼粗铜(含银、金、铁、锌杂质),装置如图乙所示.下列说法不正确的是B.
A.Y极为粗铜、X极为纯铜
B.X极净增质量等于Y极净减质量
C.铜盐溶液作精炼铜的电解质溶液
D.若电路有1mol电子转移,则X极净增32g
(4)几种金属离子的沉淀pH:
| 金属氢氧化物 | 开始沉淀pH | 完全沉淀的pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.7 |
| Cu(OH)2 | 4.6 | 6.4 |
| Zn(OH)2 | 5.9 | 8.9 |
| A. | Na2CO3溶液c(Na+)与c(CO32-)之比为2:1 | |
| B. | pH=2和pH=1的硝酸中c(H+)之比为1:10 | |
| C. | 0.2 mol/L与0.1 mol/L醋酸中c(H+)之比为2:1 | |
| D. | pH=1的硫酸中加入等体积0.1 mol/L的BaCl2溶液,两者恰好反应 |
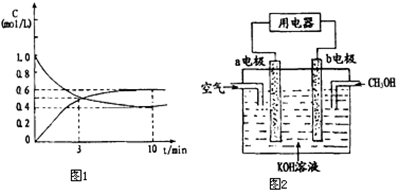
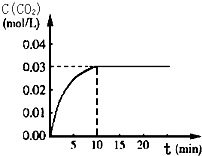 K增大的有A(填字母)
K增大的有A(填字母) 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.