题目内容
5.根据所学化学知识计算:(1)6.02×1022个Na+的物质的量为:0.1mol.
(2)3molH2O的质量为:54g.
(3)同温同压下,同体积的CH4和CO2物质的量之比为1:1; 分子个数之比1:1;原子个数之比5:3;质量比4:11.
分析 (1)根据n=$\frac{N}{{N}_{A}}$计算;
(2)根据m=nM计算;
(3)根据阿伏加德罗定律可知,同温同压下同体积的CH4和CO2的物质的量相同,根据分子的组成和分子的相对分子质量计算粒子个数以及质量等关系.
解答 解:(1)n=$\frac{N}{{N}_{A}}$=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}}$=0.1mol;
故答案为:0.1mol;
(2)3molH2O的质量为m=nM=3mol×18g/mol=54g;
故答案为:54g;
(3)根据阿伏加德罗定律可知,同温同压下同体积的CO2和CO的物质的量相同,物质的量之比为1:1,
设CO2和CO的物质的量都为1mol,
则根据N=n•NA可知:气体的分子数之比等于物质的量之比,为1:1;
1个CH4中含有5个原子,1个CO2中含有3个原子,则原子数之比为1×5:1×3=5:3,
1molCH4的质量为1mol×16g/mol=16g,1molCO2的质量为1mol×44g/mol=44g,质量之比为16:44=4:11,
故答案为:1:1; 1:1; 5:3;4:11.
点评 本题考查阿伏加德罗定律及其推论,涉及物质的量的有关计算,题目难度不大,注意相关计算公式的运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入1L的密闭容器中发生反应:CH4(g)+2NO2(g)
N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.
测得有关数据如表:
下列说法正确的是( )
N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.
测得有关数据如表:
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
| A. | T1>T2,且a>0 | |
| B. | 当温度为T2、反应进行到40 min时,x>0.15 | |
| C. | 温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol | |
| D. | 温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50 molH2O(g),反应开始时,ν(正)>ν(逆) |
13.下列实验方法正确的是( )
| A. | 用淀粉溶液检验溶液中是否存在碘离子 | |
| B. | 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| C. | 用Na2CO3溶液鉴别HCl溶液和H2SO4溶液 | |
| D. | 用焰色反应鉴别NaCl和KNO3 |
20.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24LCl2溶于水时转移的电子数为0.1NA | |
| B. | 过氧化钠与水反应时,生成0.1molO2时转移的电子数为0.2NA | |
| C. | 标准状况下,2.24LNO2与水反应生成NO3-的数目为0.1NA | |
| D. | 用惰性电极电解饱和食盐水,生成4.0gNaOH的同时,生成的气体分子总数为0.05NA |
10.下列物质按电解质、非电解质、混合物排序正确的是( )
| A. | 盐酸、硫酸、五水硫酸铜 | B. | NH3、Cu、空气 | ||
| C. | NaOH、SO2、空气 | D. | 氨水、食盐、酒精 |
17.设NA为阿伏加德罗常数的值,下列说法正确的组合是( )
a.12g 金刚石中含有的碳碳键的数目为2NA
b.1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c.1mol Na2O2与水反应转移的电子数为NA
d.常温下,1mol•L-1的NH4NO3溶液中含有氮原子的数目为2NA
e.标准状况下,2.24L C6H14含原子总数大于2NA
f.17g H2O2中含有的电子数为9NA
g.将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h.常温下,100mL 1mol•L-1 AlCl3溶液中阳离子总数大于0.1NA.
a.12g 金刚石中含有的碳碳键的数目为2NA
b.1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c.1mol Na2O2与水反应转移的电子数为NA
d.常温下,1mol•L-1的NH4NO3溶液中含有氮原子的数目为2NA
e.标准状况下,2.24L C6H14含原子总数大于2NA
f.17g H2O2中含有的电子数为9NA
g.将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h.常温下,100mL 1mol•L-1 AlCl3溶液中阳离子总数大于0.1NA.
| A. | a c f h | B. | a c e g | C. | a c e f h | D. | b d e h |
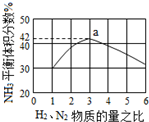 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.