题目内容
铷和另一种碱金属的合金7.8 g,与足量水完全反应后,放出氢气0.20 g,则合金中另一种碱金属可能是( )
| A.Li | B.Na | C.K | D.Cs |
AB
题目中所涉及的金属均为碱金属,可写出合金与水反应的通式,通过求平均相对原子质量来确定另一种碱金属的种类。
因合金由碱金属组成,故设合金为M,平均相对原子质量为x,
2M+2H2O====2MOH+H2↑
2x 2
7.8 g 0.2 g
2x∶2="7.8" g∶0.2 g x=39
因为铷的相对原子质量大于39,所以另一碱金属的相对原子质量必小于39,Li、Na的相对原子质量分别为6.9、23,符合题意。
因合金由碱金属组成,故设合金为M,平均相对原子质量为x,
2M+2H2O====2MOH+H2↑
2x 2
7.8 g 0.2 g
2x∶2="7.8" g∶0.2 g x=39
因为铷的相对原子质量大于39,所以另一碱金属的相对原子质量必小于39,Li、Na的相对原子质量分别为6.9、23,符合题意。

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
 2Na++2OH-+H2↑
2Na++2OH-+H2↑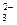 +2H+
+2H+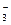 +OH-
+OH-