题目内容
将铷和另一碱金属组成的混合物4.6 g与水反应,生成了0.2 g氢气,则另一碱金属可能是( )
| A.锂 | B.钠 | C.铯 | D.以上三种都有可能 |
A
假设4.6 g全部是铷,生成的氢气小于0.2 g,由此可知另一碱金属若为4.6 g,生成的氢气质量一定大于0.2 g,设另一碱金属的相对原子质量为Ar,则
2M+2H2O====2MOH+H2↑
2Ar 2
4.6 g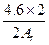 g>0.2 g
g>0.2 g
所以Ar<23,一定是锂。
2M+2H2O====2MOH+H2↑
2Ar 2
4.6 g
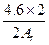 g>0.2 g
g>0.2 g所以Ar<23,一定是锂。

练习册系列答案
相关题目